Pod wieloma względami słońce ma pozytywny wpływ na zdrowie i dobre samopoczucie człowieka. Promieniowanie słoneczne jest wprawdzie naturalnym czynnikiem środowiskowym, niemniej jednak może stanowić duże zagrożenie dla zdrowia, zwłaszcza w przypadku nadmiernej ekspozycji. W szczególności promieniowanie ultrafioletowe (UV) może prowadzić do niebezpiecznych mutacji w DNA chromosomalnym i mitochondrialnym.
Przez długi czas zakładano, że mitochondria nie posiadają mechanizmów naprawy DNA lub posiadają je tylko w ograniczonym zakresie, jednak w ostatnich latach pogląd ten uległ całkowitej zmianie. Dziś wiemy na przykład, że mitochondria dysponują skutecznymi mechanizmami naprawy oksydacyjnych uszkodzeń DNA, takich jak 8-oksoguanina. Jednak w przeciwieństwie do jądra komórkowego mitochondria nie są w stanie przeprowadzać naprawy fotoproduktów, takich jak dimery CPD, ponieważ nie posiadają systemu naprawy przez wycinanie nukleotydów (NER). Procesy naprawy DNA w jądrze komórkowym wymagają odpowiedniego zaopatrzenia w energię, co pokazuje jak duże znaczenie odgrywają mitochondria w procesach naprawy chromosomalnego DNA. Dalsze procesy, takie jak endogenna inicjacja apoptozy oraz udział w biosyntezie nukleotydu, podkreślają centralną rolę mitochondriów w zapewnieniu stabilności genomu. Mitochondria są zaangażowane w wiele innych istotnych procesów metabolicznych zachodzących w komórkach, co tylko potwierdza ich znaczenie dla zdrowia całego organizmu oraz poszczególnych komórek. Badania poświęcone mechanizmom naprawy DNA oraz szkodliwemu, a także protekcyjnemu wpływowi na funkcjonowanie mitochondriów odgrywają współcześnie ważną rolę w leczeniu i zapobieganiu wielu chorób. Jednocześnie pozwalają lepiej zrozumieć przebieg i wzajemne oddziaływanie procesów starzenia w naszych komórkach. Poniższy artykuł opisuje wpływ promieni UV na funkcjonowanie mitochondriów oraz naprawę uszkodzeń mitochondrialnego DNA wywołanych promieniowaniem UV. W zakresie protekcji odnosimy się do prac własnych, które wskazują na działanie Mitoceutyków® i składników aktywnych produktów przeciwsłonecznych.
Powstanie uszkodzeń indukowanych promieniowaniem słonecznym oraz ich mutagenność
Promieniowanie słoneczne może mieć toksyczny wpływ na skórę człowieka i prowadzić m.in. do powstania raka skóry oraz fotostarzenia. Najbardziej zasobna w energię część promieniowania (UVC) jest wchłaniana przez warstwę ozonową, dlatego w kontekście szkód DNA kluczową rolę odgrywają promienie UVA i UVB [1]. Promieniowanie UV wnika w skórę, gdzie w zależności od długości fal energia wchłaniana jest przez molekuły komórkowe, takie jak DNA. Jako najważniejszy czynnik ryzyka powstania raka skóry postrzegane jest widmo UVB, które powoduje bezpośrednie uszkodzenia DNA, takie jak cyklobutanowe dimery pirymidynowe (CPD) oraz fotoprodukty 6-4 [2]. Badania in vivo na ludzkiej skórze wykazały, że fotoprodukty DNA indukowane promieniowaniem UVB odgrywają kluczową rolę w procesach fotostarzenia (przyspieszonego starzenia skóry) [3]. CPD to uszkodzenia ludzkiego DNA chromosomalnego skóry spowodowane promieniowaniem słonecznym. Ponieważ w DNA występują dwa rodzaje pirymidyn, może dojść do powstania czterech rodzajów CPD: dimerów TT, dimerów TC, dimerów CT i CC. Te ostatnie wykazują się największą mutagennością, choć są najmniej liczne spośród wszystkich CPD [4]. Widmo UVA promieniowania słonecznego, poza wywoływaniem bezpośrednich uszkodzeń DNA w związku z powstaniem reaktywnych form tlenu (ROS), prowadzi także do zmian pośrednich, takich jak 8-oksoguanina. Szczególnie wrażliwe w tym kontekście jest DNA mitochondrialne (mtDNA), ponieważ zakodowane są na nim niezbędne białka łańcucha oddechowego, a dodatkowo w porównaniu do DNA chromosomalnego mtDNA ma mniejszą ochronę przed powstawaniem uszkodzeń DNA [5-8]. Mutacja mitochondrialnego DNA często prowadzi do defektów białek łańcucha oddechowego, co z kolei może wpływać na zwiększoną produkcję mitochondrialnych ROS (mtROS). Zgodnie z „teorią starzenia mitochondialnego” mtROS oraz inne uszkodzenia oksydacyjne mtDNA odgrywają bardzo ważną rolę w procesach starzenia oraz chorobach wieku starczego. Szczegółowe doniesienia na temat powstawania mtROS oraz ich dokładnych ilości pozostają kontrowersyjne [9,10], pomimo że już w latach 80-ych i 90-ych ubiegłego wieku wykazano, że ROS powodują duże uszkodzenia mtDNA [11,12].
Mutagenność uszkodzeń DNA zależy od wielu aspektów, nie tylko od częstotliwości czynników spustowych czy skuteczności procesów naprawczych. Na przykład istotny jest stan metylacji DNA. Pomimo, że mtDNA posiada swoisty wzorzec metylacji, niewiele wiadomo na temat jego potencjalnej mutagenności [13]. Kolejną szkodą z poważnymi skutkami dla funkcjonowania mitochondriów jest rozległa delecja (CD) obejmująca 4977 par zasad. Jest ona uważana za złoty standard uszkodzeń mitochondrialnych w obszarze fotostarzenia i jest indukowana w komórkach skóry zarówno in vivo, jak i in vitro przez tlen singletowy wytwarzany w wyniku kontaktu z promieniami UVA [14, 15]. Najbardziej prawdopodobnym mechanizmem powstawania delecji CD jest błędna naprawa podwójnych pęknięć nici, gdzie następuje niewłaściwa rekombinacja dwóch powtórzeń sekwencji w mtDNA oraz zamknięcie podwójnego pęknięcia [16]. Podwójne pęknięcia powstają w procesie replikacji DNA, po powstaniu pojedynczego pęknięcia, a także mogą stanowić produkt uboczny naprawy nagromadzonych uszkodzeń oksydacyjnych przez wycinanie zasad (BER). Do powstawania delecji CD mogą przyczyniać się nie tylko podwójne pęknięcia, lecz także dimery CPD. Gdy tylko w miejscu takiego uszkodzenia nie dochodzi do replikacji, mogą powstać jednoniciowe odcinki DNA, które sprzyjają indukcji podwójnych pęknięć [16]. Wydaje się to jednak mało prawdopodobne, ze względu na to, że podanie antyoksydantów, takich jak koenzym Q10 zapobiega delecji CD w wyniku działania promieni UVA [14].
W minionych latach opisano szereg mutacji mitochondrialnych, występujących częściej w skórze poddanej działaniu promieni UV, wynikających z uszkodzeń spowodowanych promieniowaniem słonecznym, takich jak CPD, fotoprodukty 6-4, 8-oksoguanina, pęknięcia pojedynczej nici oraz podwójnych nici [17-19]. Poza delecją CD, mutacje te charakteryzują się transwersją T414G oraz duplikacjami tandemowymi. Co ciekawe, za wszystkimi powyższymi mutacjami kryje się stres oksydacyjny, w związku z czym występują one także w tkankach nie wystawionych na działanie UV, lecz poddanych innym rodzajom stresu oksydacyjnego [20-24]. W rozważaniach na temat wpływu promieniowania słonecznego na mitochondria należy także wziąć pod uwagę, że również mutacje chromosomalnego DNA mogą mieć duży wpływ na funkcjonowanie mitochondriów, ponieważ większość białek mitochondrialnych jest kodowanych w jądrze. Na rycinie 1 przedstawiono zależność między funkcjonowaniem mitochondriów, a naprawą DNA w jądrze komórkowym i mitochondriach.
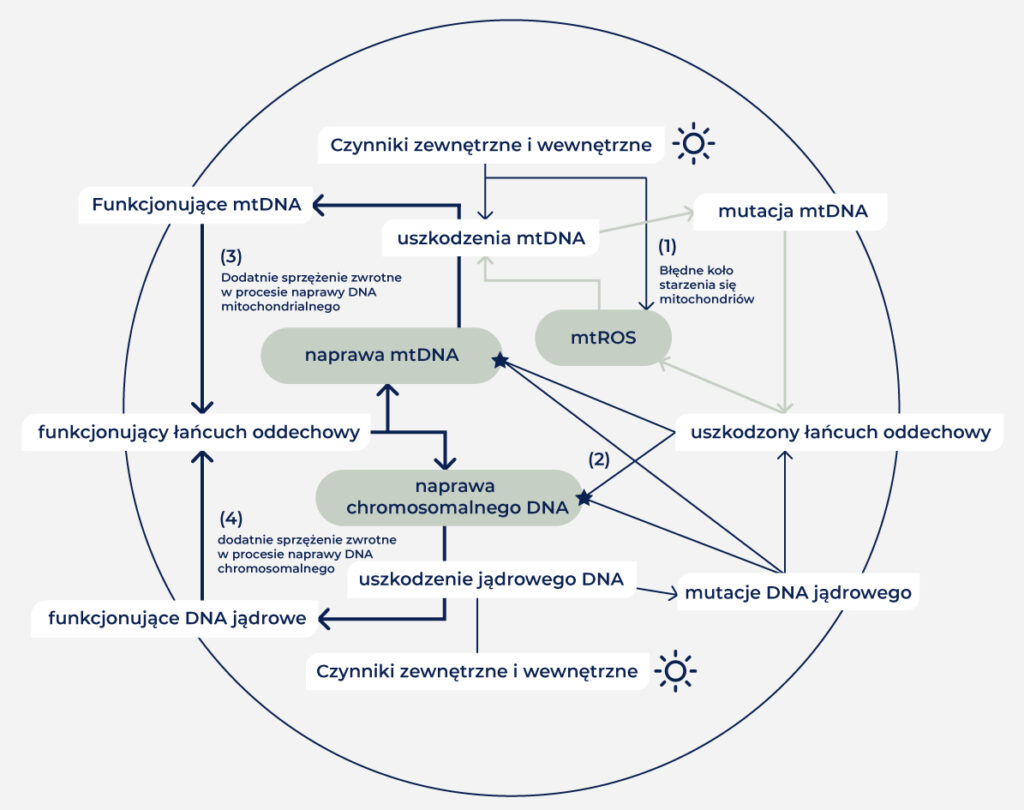
Czynniki egzogenne i endogenne (1) mogą powodować uszkodzenia mitochondrialnego DNA (mtDNA) bezpośrednio lub przez reaktywne formy tlenu (ROS). Jeśli uszkodzenia nie zostaną naprawione, powstają mutacje, które prowadzą do wytwarzania wadliwych białek łańcucha oddechowego. Wadliwe białka łańcucha oddechowego mogą spowodować zaburzenie funkcjonowania łańcucha oddechowego, co z kolei prowadzi do zwiększonego uwalniania ROS i zamyka „błędne koło”. Również mutacje w jądrze mogą wpływać na mitochondria, jeśli dotyczą białek mitochondrialnych kodowanych chromosomalnie (2). Zaburzone funkcjonowanie / oddychanie mitochondrialne może na różne sposoby negatywnie wpływać na naprawę DNA w komórkach, a tym samym (3,4) na komórkowe mechanizmy obronne, które są istotne dla utrzymania funkcji oddychania.
Jak mitochondria naprawiają uszkodzenia DNA
Przez długi czas nie wiedziano jaki wpływ na mitochondria, komórki i ostatecznie na cały organizm mają nienaprawialne fotoprodukty mitochondrialne. Wiele wskazuje na to, że uszkodzenia mtDNA odgrywają kluczową rolę w procesach fotostarzenia oraz w powstawaniu różnych chorób [25]. Dla patogenezy szczególne znaczenie mają prawdopodobnie oksydacyjne uszkodzenia mitochondrialne [26]. Na pierwszy rzut oka wygląda to jak paradoks, ponieważ mitochondria nie posiadają szlaków naprawy dla CPD i innych uszkodzeń DNA wywołanych promieniowaniem UV, natomiast posiadają funkcjonującą obronę antyoksydacyjną oraz mechanizm naprawy BER, pozwalający usunąć oksydacyjne uszkodzenia DNA [27]. Brak szlaku naprawy pozwalającego usunąć mitochondrialne CPD został dowiedziony już w latach 70-tych ubiegłego wieku [28]. Na tej podstawie wnioskowano brak mitochondrialnych mechanizmów naprawy DNA, a także wyjaśniano wysoki odsetek mutacji mitochondrialnych. Fakt, że mutagenność tego typu uszkodzeń DNA w mitochondriach jest jednak stosunkowo niska, sugeruje dwie możliwości. Z jednej strony, możliwość w dużej mierze bezbłędnej replikacji ponad miejscem uszkodzenia przy użyciu jedynej znanej polimerazy mitochondrialnego DNA γ (Polγ), a z drugiej strony możliwość całkowitej blokady replikacji w miejscu uszkodzeń. W rzeczywistości wykazano, że zarówno Polγ, jak i polimeraza mitochondrialnego RNA mają trudności w replikacji i transkrypcji ponad uszkodzeniami DNA [29,30]. Polγ nie ulega zahamowaniu w obecności uszkodzeń oksydacyjnych, takich jak 8-oksoguanina, a w 30% przypadków umożliwia wbudowanie dATP w miejsce uszkodzeń [31]. Aktywność polimerazy mitochondrialnego RNA również nie ulega zahamowaniu. Pomimo, że w mitochondriach może dojść do naprawy uszkodzeń oksydacyjnych DNA, to nie zachodzi tam naprawa fotoproduktów takich jak CPD, dlatego wpływ stresu oksydacyjnego na integralność i funkcjonowanie genomu mitochondrialnego wydaje się być dużo poważniejszy.
Podczas procesu usuwania szkód oksydacyjnych mogą ze sobą konkurować dwa mechanizmy: degradacja mtDNA oraz naprawa tego DNA [32]. Badania wykazały, że zaledwie kilka godzin po indukcji stresu oksydacyjnego in vitro oraz in vivo dochodzi do utraty mtDNA, więc wszystko wskazuje na to, że degradacja DNA rzeczywiście konkuruje z naprawą DNA o uszkodzenia [5, 33]. Bess et al. wykazali, że mitochondria zawierające DNA z uszkodzeniami typu CPD są usuwane w przeciągu 48 do 72 godzin na drodze mitofagii [34,35]. Autorzy tego artykułu również wykazali, że poddanie fibroblastów w ludzkiej skórze promieniowaniu symulującemu światło słoneczne (SSL) powoduje znaczący wzrost liczby kopii mtDNA 72 i 96 godzin później. Efekt taki nie występował po ekspozycji na promieniowanie UVC [24]. Zmiany liczby kopii mtDNA mogą odzwierciedlać różne rodzaje usuwania uszkodzeń mitochondrialnego DNA, a zwiększenie liczby kopii mtDNA może być ważnym czynnikiem zwiększającym tolerancję na uszkodzenia DNA. W naszej pracy wykazaliśmy, że skóra eksponowana na słońce cechowała się mocno podwyższoną delecją CD, a także zwiększoną liczbą kopii mitochondrialnych. Nie zaobserwowano natomiast jednoczesnego wzrostu tranzycji charakterystycznych dla dimerów CPD (ryc. 2) [24].
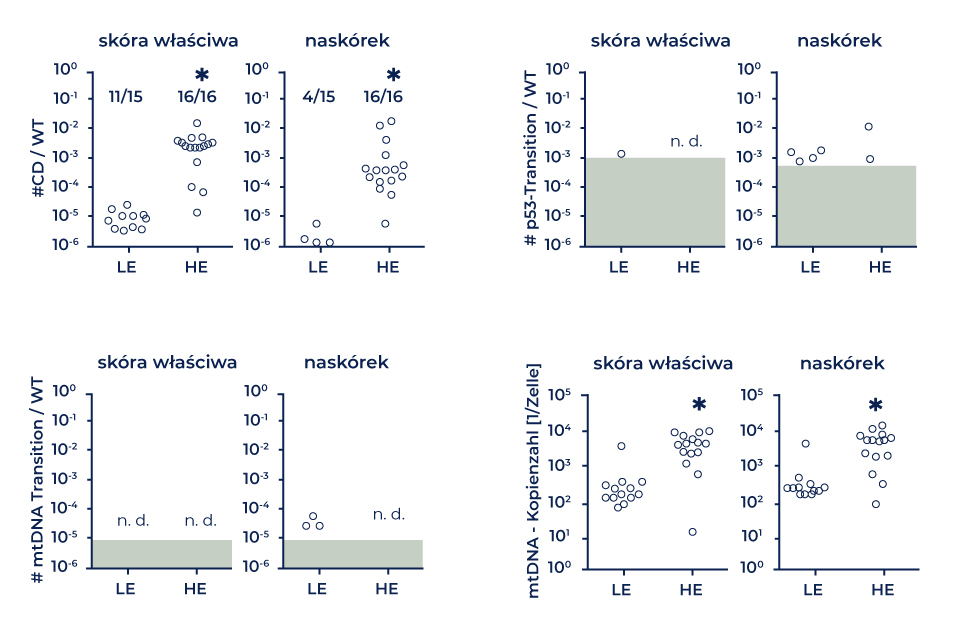
Przed wyizolowaniem i przeprowadzeniem analizy DNA próbki skóry właściwej i naskórka po umiarkowanej (LE) i dużej (HE) ekspozycji na słońce zostały odseparowane enzymatycznie. Liczba mutacji została wyrażona jako stosunek do liczby kopii typu dzikiego (WT), a liczba kopii mtDNA jako stosunek między liczbą kopii mtDNA a liczbą kopii białka p53 w próbkach (test U Manna-Whitneya) (*p<0,0001) [24].
Mitochondria a brakujący mechanizm naprawy przez wycięcie nukleotydu (NER)
Mechanizm naprawy NER składa się z ponad 30 białek i można go podzielić na dwa swoiste podmechanizmy: naprawa sprzężona z transkrypcją (TC-NER) oraz globalna naprawa genomu (GG-NER) [36]. Znaczenie naprawy NER można dobitnie wykazać na przykładzie pacjentów z mutacjami germinalnymi, takimi jak Xeroderma Pigmentosum (XP, skóra pergaminowata), które obejmują geny szlaku GG-NER. Pacjenci cierpiący na tę chorobę zapadają na nowotwory skóry już we wczesnym dzieciństwie. Jeśli mutacje germinalne obejmują geny, które można przyporządkować szlakowi naprawy TC-NER, jak na przykład geny CSA i CSB, u osób takich rozwija się zespół progeroidalny i następuje neurodegeneracja [37].
Pomimo, że w toku ewolucji mitochondria znalazły sposób na skompensowanie braku naprawy przez wycinanie nukleotydów, to jednak w ostatnich latach wykazano ścisły związek między funkcjonowaniem mitochondriów a szlakiem naprawy NER. NER wydaje się być również zaangażowany w homeostazę redoks i metabolizm energetyczny [38].
CSA i CSB
Czynniki szlaku naprawy TC-NER, które biorą udział w werbowaniu i zestawianiu mechanizmów naprawczych na wczesnych etapach szlaku NER [50]. CSB bierze udział między innymi w komunikacji jądro-mitochondria, mitochondrialnym mechanizmie naprawy BER i autofagii mitochondrialnej [39]. Białka CSA i CSB są transportowane do mitochondriów po wystąpieniu stresu oksydacyjnego i tam wchodzą m.in. w interakcje z mtDNA i mitochondrialną ludzką glikozylazą 8-oksoguaniny 1 (hOGG1).
XPC
Centralne białko szlaku naprawy GG-NER biorące udział w procesie rozpoznawania uszkodzeń. Uważa się również, że białko XPC bierze udział w naprawie BER, homeostazie redoks i regulacji cyklu komórkowego [40]. W ekstraktach komórkowych białko XPC oddziałuje z glikozydazą hOGG1 i zwiększa jej aktywność w zakresie wycinania [41]. W ludzkich keratynocytach niedobór białka XPC wyzwala zwiększony poziom ROS, nasila uszkodzenia mtDNA i zwiększa poziom delecji mtDNA.
XPA
Bierze udział w tworzeniu kompleksu naprawczego i jego stabilizacji [36]. Pacjenci, u których występuje niedobór białek XPA i CSB wykazują podobne objawy kliniczne jak pacjenci z klasycznymi chorobami mitochondrialnymi, takimi jak MELAS. Komórki z niedoborem XPA wykazują podwyższony potencjał błonowy, zwiększone tworzenie ROS, zwiększony metabolizm mitochondrialny i zwiększone zużycie ATP, czemu towarzyszą defekty mitofagii.
p53
Białko supresorowe nowotworów, które poza wieloma innymi funkcjami jest zaangażowane w szlak naprawy GG-NER. Może również docierać do mitochondriów, gdzie m.in. bierze udział w regulacji apoptozy [42]. Białko p53 może oddziaływać bezpośrednio z F1F0-ATPazą i w ten sposób bezpośrednio regulować oddychanie mitochondrialne [43]. Ponadto, p53 jest w stanie utrzymać funkcjonowanie mitochondrialnej polimerazy DNA po napromieniowaniu światłem UVB i zapewnić przetwarzanie uszkodzeń DNA [44].
PARP-1
Wielofunkcyjne białko, wykorzystujące cząsteczki NAD+, które rozpoznaje pęknięcia pojedynczej nici DNA i bierze udział w naprawie DNA. W jądrze PARP-1 może bezpośrednio wpływać na mechanizm naprawy NER np. poprzez interakcje z białkami XPC i XPA [45, 46]. PARP-1 wpływa również na mechanizm naprawy BER poprzez stabilizowanie intermediatów jednoniciowych lub hamowanie kluczowych białek mechanizmu BER, takich jak hOGG1 [47, 48]. Wyciszenie PARP-1 prowadzi do zwiększenia oddychania mitochondrialnego oraz wzrostu poziomu uszkodzeń mtDNA [49, 50].
hOGG1 (BER) Niezbędny enzym mechanizmu naprawy BER, będący głównym antagonistą oksydacyjnych uszkodzeń DNA [51]. Usuwa on produkt utleniania 8-oxoG, będący uszkodzeniem mitochondrialnego i genomowego DNA lub RNA, spowodowanym przez reaktywne formy tlenu (ROS), a tym samym zapobiega rozwojowi mutacji [52]. Spośród ośmiu różnych izoform enzymu hOGG1, siedem wykryto w mitochondriach [53].
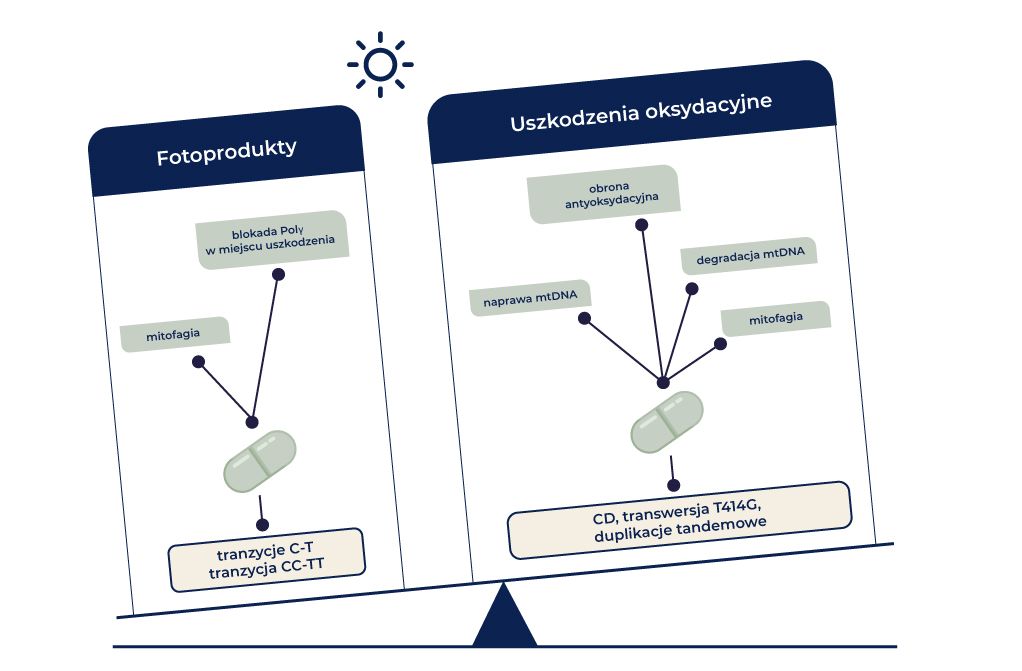
Fotoprodukty stanowią wprawdzie lwią część uszkodzeń DNA wywołanych przez światło słoneczne, ale większość mutacji mtDNA wywołanych przez słońce jest pochodzenia oksydacyjnego. Na pierwszy rzut oka wydaje się to paradoksalne, ponieważ mitochondria robią wszystko, aby uniknąć takich mutacji, a nawet wykorzystują w tym celu białka, które są przypisane przede wszystkim do szlaku naprawy NER.
CoQ10 jako substancja aktywna medycyny mitochondrialnej
Medycyna mitochondrialna stała się centralnym wymiarem w całej dziedzinie medycyny. Dziedziczne mitochondriopatie, a także czynniki środowiskowe, takie jak promieniowanie UV, odgrywają obecnie istotną rolę w wywoływaniu dysfunkcji mitochondriów. Szczególną uwagę zwraca się tu na mutacje takie jak dimery CPD i 8-oksoguanina. Mitoceutyki®, a wśród nich koenzym Q10 (CoQ10), stanowią ważny element terapii. Właściwości chemiczne cząsteczki CoQ10 sprawiają, że pełni ona ważne funkcje w organizmie człowieka. CoQ10 jest ważnym endogennym elementem łańcucha transportu elektronów (ETC) [54]. Ze względu na silne właściwości przeciwutleniające skutecznie zapobiega peroksydacji lipidów i chroni zarówno genomowe, jak i mitochondrialne DNA podczas stresu oksydacyjnego, a także lipidy i białka [54, 55]. Oprócz badań nad substancją aktywną, w testach produktu udało nam się wykazać, że po podaniu zredukowanej formy CoQ10 po ekspozycji słonecznej można zaobserwować przyspieszoną regenerację poziomu komórkowego ATP (ryc. 4) w fibroblastach skóry ludzkiej. Towarzyszył temu zachowany potencjał błonowy mitochondriów oraz zwiększona respiracja (ryc. 5) [56].
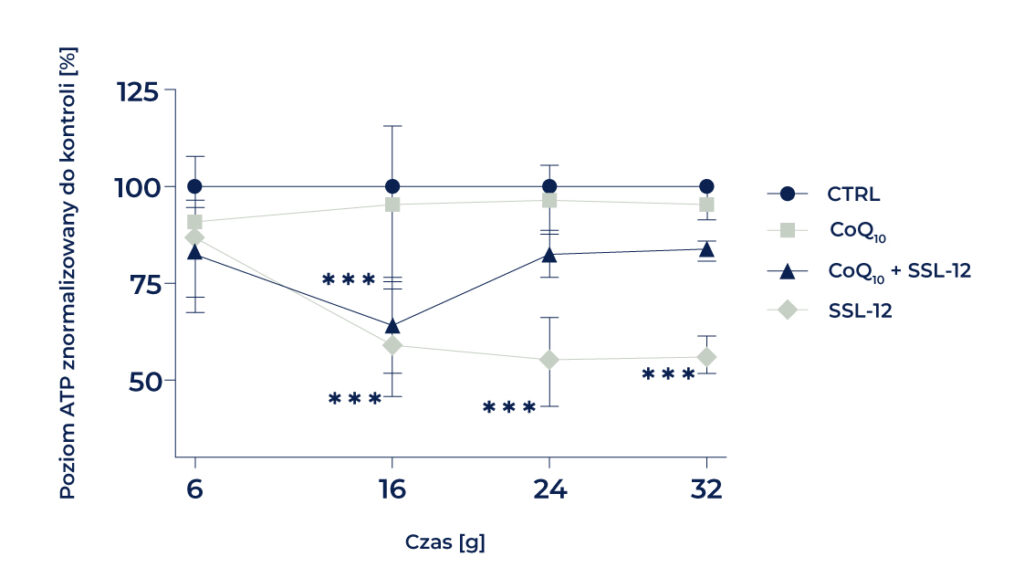
Fibroblasty inkubowano na podłożu do hodowli komórkowych z dodatkiem i bez dodatku CoQ10 oraz napromieniowano światłem symulującym promieniowanie słoneczne o energii 12 J/cm2 (SSL-12) 16 godzin po posianiu komórek. Po napromieniowaniu przeprowadzono kolejny etap inkubacji, trwający odpowiednio 6, 16, 24 i 32 godziny. Po upływie wyznaczonego czasu inkubacji komórki były zbierane, liczone, a 35.000 komórek z lizatów komórkowych wykorzystywano do oznaczania poziomu ATP. (n = 3, średnia ± SEM, 2-czynnikowa ANOVA z testem Bonferroniego versus grupa kontrolna bez dodatku (CTRL), p *** <0,001). CTRL wynosi 100% w każdym punkcie czasowym. CoQ10 = QuinoMit®Q10 fluid; MSE Pharmazeutika GmbH, Bad Homburg [56].
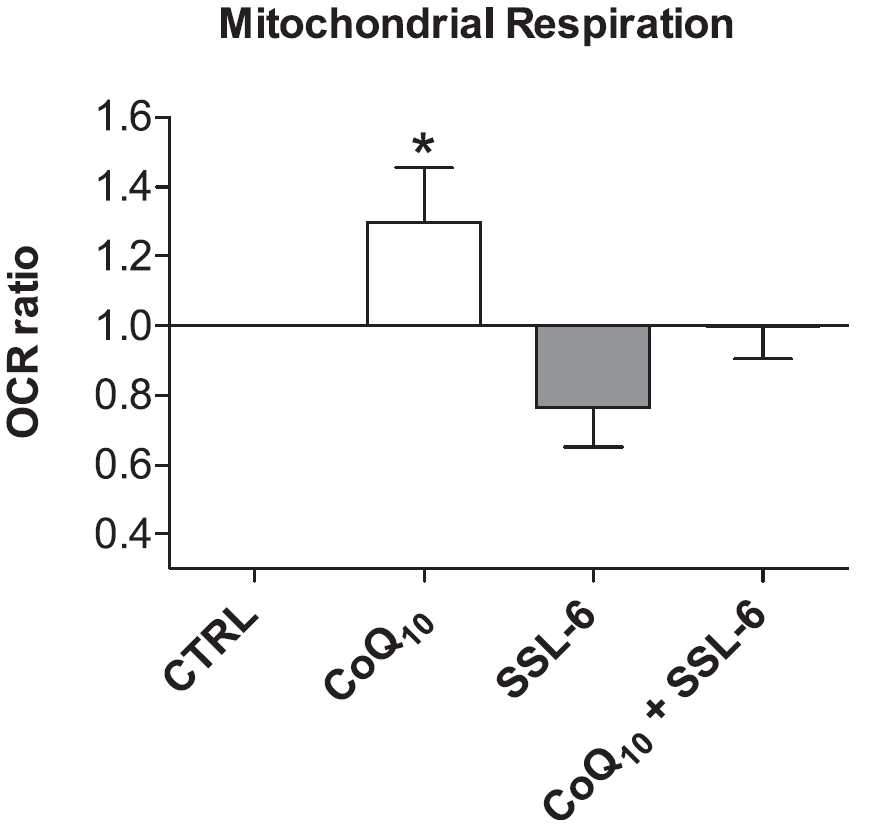
Ryc. 5. Wpływ CoQ10 na oddychanie mitochondrialne w fibroblastach po ekspozycji na słońce.
Fibroblasty inkubowano przez 1 h na podłożu do hodowli komórkowych z dodatkiem i bez dodatku CoQ10, a następnie napromieniowano światłem symulującym promieniowanie słoneczne (SSL-6) o energii 6 J/cm2 . Po napromieniowaniu następował kolejny etap inkubacji w podłożu do hodowli komórkowych z dodatkiem lub bez dodatku CoQ10 przez 16 h. Następnie przy użyciu analizatora XF prowadzono pomiary oddychania mitochondrialnego (n = 5, średnia _SEM, 1-czynnikowa ANOVA z wieloczynnikowym testem Dunnetta versus grupa kontrolna, *P < 0.05). Komórki z grupy kontrolnej odpowiadają wartości 1.0. OCR = oxygen consumption rate. CoQ10 = QuinoMit®Q10 fluid; MSE Pharmazeutika GmbH, Bad Homburg [56].
Wniosek
Skóra człowieka codziennie poddawana jest wpływowi szkodliwych czynników, spośród których największe znaczenie biologiczne ma promieniowanie ultrafioletowe (UV) emitowane przez słońce. Do uszkodzeń komórkowych indukowanych przez promieniowanie UV należą przede wszystkim zmiany DNA, takie jak dimery CPD. Dodatkowo, powstałe reaktywne formy tlenu ROS prowadzą do utleniania DNA, białek i lipidów. Stres oksydacyjny dotyczy przede wszystkim mitochondriów – organelli komórkowych, w których powstaje najwięcej endogennych ROS. Ze względu na brak mechanizmu naprawy fotoproduktów w mitochondriach przez długi czas zakładano ogólny brak procesów naprawczych mtDNA [28]. W ostatnich latach wykazano jednak, że większość szlaków naprawy DNA, z wyjątkiem NER, jest w pełni obecnych w mitochondriach [27]. Promieniowanie słoneczne powoduje głównie uszkodzenia DNA w mitochondriach, które nie mogą być naprawione na drodze wycięcia nukleotydu (NER). Brak tego szlaku naprawy DNA może być ważnym czynnikiem w mutagenezie mtDNA i wynikającej z niej dysfunkcji mitochondriów. Wydaje się jednak, że główną przyczyną dysfunkcji mitochondriów są uszkodzenia oksydacyjne, za czym przemawia istnienie skutecznych mechanizmów obrony przed tymi uszkodzeniami [27]. Wydaje się, że brak naprawy fotoproduktów, takich jak CPD, odgrywa tu jedynie niewielką rolę. Z drugiej strony, białka NER zdają się wpływać na funkcjonowanie mitochondriów na wiele innych sposobów. Niektóre z tych białek są nawet obecne w samych mitochondriach, gdzie są bezpośrednio zaangażowane w naprawę uszkodzeń oksydacyjnych. Koenzym Q10 odgrywa również ważną rolę jako substancja czynna w utrzymaniu funkcji mitochondriów po uszkodzeniach spowodowanych działaniem promieni słonecznych. Przypisuje się to głównie właściwościom antyoksydacyjnym CoQ10. Ponadto podejrzewa się, że CoQ10 stymuluje enzymy naprawy DNA hOGG1 [57].
Dr. rer. nat. Daniel Schniertshauer, Prof. Dr. rer. nat. Jörg Bergemann, Hochschule Albstadt-Sigmaringen, Wydział Biomedycyny, Anton-Günther-Straße 51, 72488 Sigmaringen | Niemcy
Bibliografia:
[1] Jackson SP, Bartek J. The DNA-damage response in human biology and disease. Nature. 2009; 461(7267): 1071-1078.
[2] de Gruijl FR, Sterenborg HJ, Forbes PD, Davies RE, Cole C, Kelfkens G, van Weelden H, Slaper H, van der Leun JC. Wavelength dependence of skin cancer induction by ultraviolet irradiation of albino hairless mice. Cancer Res. 1993; 53(1): 53-60.
[3] Tewari A, Lahmann C, Sarkany R, Bergemann J, Young AR. Human erythema and matrix metalloproteinase-1 mRNA induction, in vivo, share an action spectrum, which suggests common chromophores. Photochem Photobiol Sci. 2012; 11(1): 216-223.
[4] Douki T, Cadet J. Individual determination of the yield of the main UV-induced dimeric pyrimidine photoproducts in DNA suggests a high mutagenicity of CC photolesions. Biochemistry. 2001; 40(8): 2495-2501.
[5] Furda AM, Marrangoni AM, Lokshin A, Van Houten B. Oxidants and not alkylating agents induce rapid mtDNA loss and mitochondrial dysfunction. DNA Repair (Amst). 2012; 11(8): 684-92.
[6] Yoshida T, Goto S, Kawakatsu M, Urata Y, Li TS. Mitochondrial dysfunction, a probable cause of persistent oxidative stress after exposure to ionizing radiation. Free Radic Res. 2012; 46(2): 147-53.
[7] Chinnery PF, Elliott HR, Hudson G, Samuels DC, Relton CL. Epigenetics, epidemiology and mitochondrial DNA diseases. Int J Epidemiol. 2012; 41(1): 177-187.
[8] DeBalsi KL, Hoff KE, Copeland WC. Role of the mitochondrial DNA replication machinery in mitochondrial DNA mutagenesis, aging and age-related diseases. Ageing Res Rev. 2017; 33: 89-104.
[9] Lagouge M, Larsson NG. The role of mitochondrial DNA mutations and free radicals in disease and ageing. J Intern Med. 2013; 273(6): 529-543.
[10] Grivennikova VG, Vinogradov AD. Mitochondrial production of reactive oxygen species. Biochemistry (Mosc). 2013; 78(13): 1490-1511.
[11] Richter C, Park JW, Ames BN. Normal oxidative damage to mitochondrial and nuclear DNA is extensive. Proc Natl Acad Sci U S A. 1988; 85(17): 6465-6467.
[12] Yakes FM, Van Houten B. Mitochondrial DNA damage is more extensive and persists longer than nuclear DNA damage in human cells following oxidative stress. Proc Natl Acad Sci U S A. 1997; 94(2): 514-519.
[13] Bellizzi D, D’Aquila P, Scafone T, Giordano M, Riso V, Riccio A, Passarino G. The control region of mitochondrial DNA shows an unusual CpG and non-CpG methylation pattern. DNA Res. 2013; 20(6): 537-547.
[14] Berneburg M, Plettenberg H, Medve-König K, Pfahlberg A, Gers-Barlag H, Gefeller O, Krutmann J. Induction of the photoaging-associated mitochondrial common deletion in vivo in normal human skin. J Invest Dermatol. 2004; 122(5): 1277-1283.
[15] Koch H, Wittern KP, Bergemann J. In human keratinocytes the Common Deletion reflects donor variabilities rather than chronologic aging and can be induced by ultraviolet A irradiation. J Invest Dermatol. 2001; 117(4): 892-897.
[16] Krishnan KJ, Reeve AK, Samuels DC, Chinnery PF, Blackwood JK, Taylor RW, Wanrooij S, Spelbrink JN, Lightowlers RN, Turnbull DM. What causes mitochondrial DNA deletions in human cells? Nat Genet. 2008; 40(3): 275-279.
[17] Peak MJ, Peak JG. Hydroxyl radical quenching agents protect against DNA breakage caused by both 365-nm UVA and by gamma radiation. Photochem Photobiol. 1990; 51(6): 649-652.
[18] Kielbassa C, Roza L, Epe B. Wavelength dependence of oxidative DNA damage induced by UV and visible light. Carcinogenesis. 1997; 18(4): 811-816.
[19] Mouret S, Baudouin C, Charveron M, Favier A, Cadet J, Douki T. Cyclobutane pyrimidine dimers are predominant DNA lesions in whole human skin exposed to UVA radiation. Proc Natl Acad Sci U S A. 2006; 103(37): 13765-13770.
[20] Cortopassi GA, Shibata D, Soong NW, Arnheim N. A pattern of accumulation of a somatic deletion of mitochondrial DNA in aging human tissues. Proc Natl Acad Sci U S A. 1992; 89(16): 7370-7374.
[21] Lee HC, Pang CY, Hsu HS, Wei YH. Differential accumulations of 4,977 bp deletion in mitochondrial DNA of various tissues in human ageing. Biochim Biophys Acta. 1994; 1226(1): 37-43.
[22] Liu VW, Zhang C, Nagley P. Mutations in mitochondrial DNA accumulate differentially in three different human tissues during ageing. Nucleic Acids Res. 1998; 26(5): 1268-1275.
[23] Birket MJ, Birch-Machin MA. Ultraviolet radiation exposure accelerates the accumulation of the aging-dependent T414G mitochondrial DNA mutation in human skin. Aging Cell. 2007; 6(4): 557-564.
[24] Gebhard D, Mahler B, Matt K, Burger K, Bergemann J. Mitochondrial DNA copy number – but not a mitochondrial tandem CC to TT transition – is increased in sun-exposed skin. Exp Dermatol. 2014; 23(3): 209-211.
[25] Birch-Machin MA. Mitochondria and skin disease. Clin Exp Dermatol. 2000; 25(2): 141-146.
[26] Krutmann J, Morita A, Chung JH. Sun exposure: what molecular photodermatology tells us about its good and bad sides. J Invest Dermatol. 2012; 132(3 Pt 2): 976-984.
[27] Liu P, Demple B. DNA repair in mammalian mitochondria: Much more than we thought? Environ Mol Mutagen. 2010; 51(5): 417-426.
[28] Clayton DA, Doda JN, Friedberg EC. The absence of a pyrimidine dimer repair mechanism in mammalian mitochondria. Proc Natl Acad Sci U S A. 1974; 71(7): 2777-2781.
[29] Kasiviswanathan R, Gustafson MA, Copeland WC, Meyer JN. Human mitochondrial DNA polymerase γ exhibits potential for bypass and mutagenesis at UV-induced cyclobutane thymine dimers. J Biol Chem. 2012; 287(12): 9222-9229.
[30] Nakanishi N, Fukuoh A, Kang D, Iwai S, Kuraoka I. Effects of DNA lesions on the transcription reaction of mitochondrial RNA polymerase: implications for bypass RNA synthesis on oxidative DNA lesions. Mutagenesis. 2013; 28(1): 117-123.
[31] Pinz KG, Shibutani S, Bogenhagen DF. Action of mitochondrial DNA polymerase gamma at sites of base loss or oxidative damage. J Biol Chem. 1995; 270(16): 9202-9206.
[32] Shokolenko I, Venediktova N, Bochkareva A, Wilson GL, Alexeyev MF. Oxidative stress induces degradation of mitochondrial DNA. Nucleic Acids Res. 2009; 37(8): 2539-2548.
[33] Mansouri A, Demeilliers C, Amsellem S, Pessayre D, Fromenty B. Acute ethanol administration oxidatively damages and depletes mitochondrial DNA in mouse liver, brain, heart, and skeletal muscles: protective effects of antioxidants. J Pharmacol Exp Ther. 2001; 298(2): 737-743.
[34] Bess AS, Crocker TL, Ryde IT, Meyer JN. Mitochondrial dynamics and autophagy aid in removal of persistent mitochondrial DNA damage in Caenorhabditis elegans. Nucleic Acids Res. 2012; 40(16): 7916-7931.
[35] Bess AS, Ryde IT, Hinton DE, Meyer JN. UVC-induced mitochondrial degradation via autophagy correlates with mtDNA damage removal in primary human fibroblasts. J Biochem Mol Toxicol. 2013; 27(1): 28-41.
[36] Maddukuri L, Dudzińska D, Tudek B. Bacterial DNA repair genes and their eukaryotic homologues: 4. The role of nucleotide excision DNA repair (NER) system in mammalian cells. Acta Biochim Pol. 2007; 54(3): 469-482.
[37] Cleaver JE, Lam ET, Revet I. Disorders of nucleotide excision repair: the genetic and molecular basis of heterogeneity. Nat Rev Genet. 2009; 10(11): 756-768.
[38] Hosseini M, Ezzedine K, Taieb A, Rezvani HR. Oxidative and energy metabolism as potential clues for clinical heterogeneity in nucleotide excision repair disorders. J Invest Dermatol. 2015; 135(2): 341-351.
[39] Scheibye-Knudsen M, Croteau DL, Bohr VA. Mitochondrial deficiency in Cockayne syndrome. Mech Ageing Dev. 2013; 134(5-6): 275-283.
[40] Melis JP, Luijten M, Mullenders, Leon HF, van Steeg H. The role of XPC: implications in cancer and oxidative DNA damage. Mutat Res. 2011; 728(3): 107-117.
[41] D’Errico M, Parlanti E, Teson M, Jesus BMB de, Degan P, Calcagnile A, Jaruga P, Bjørås M, Crescenzi M, Pedrini AM, Egly J, Zambruno G, Stefanini M, Dizdaroglu M, Dogliotti E. New functions of XPC in the protection of human skin cells from oxidative damage. EMBO J. 2006; 25(18): 4305-4315.
[42] Vaseva AV, Moll UM. The mitochondrial p53 pathway. Biochim Biophys Acta. 2009; 1787(5): 414-420.
[43] Bergeaud M, Mathieu L, Guillaume A, Moll UM, Mignotte B, Le Floch N, Vayssière JL, Rincheval V. Mitochondrial p53 mediates a transcription-independent regulation of cell respiration and interacts with the mitochondrial F₁F0-ATP synthase. Cell cycle. 2013; 12(17): 2781-2793.
[44] Bakthavatchalu V, Dey S, Xu Y, Noel T, Jungsuwadee P, Holley AK, Dhar SK, Batinic-Haberle I, St Clair, DK. Manganese superoxide dismutase is a mitochondrial fidelity protein that protects Polγ against UV-induced inactivation. Oncogene. 2011; 31(17): 2129-2139.
[45] Robu M, Shah RG, Petitclerc N, Brind’Amour J, Kandan-Kulangara F, Shah GM. Role of poly(ADP-ribose) polymerase-1 in the removal of UV-induced DNA lesions by nucleotide excision repair. Proc Natl Acad Sci U S A. 2013; 110(5): 1658-1663.
[46] Fischer JM, Popp O, Gebhard D, Veith S, Fischbach A, Beneke S, Leitenstorfer A, Bergemann J, Scheffner M, Ferrando-May E, Mangerich A, Bürkle A. Poly(ADP-ribose)-mediated interplay of XPA and PARP1 leads to reciprocal regulation of protein function. FEBS J. 2014; 281(16): 3625-3641.
[47] Ström CE, Johansson F, Uhlén M, Szigyarto CA, Erixon K, Helleday T. Poly (ADP-ribose) polymerase (PARP) is not involved in base excision repair but PARP inhibition traps a single-strand intermediate. Nucleic Acids Res. 2011; 39(8): 3166-3175.
[48] Noren Hooten N, Kompaniez K, Barnes J, Lohani A, Evans MK. Poly(ADP-ribose) polymerase 1 (PARP-1) binds to 8-oxoguanine-DNA glycosylase (OGG1). J Biol Chem. 2011; 286(52): 44679-44690.
[49] Rossi MN, Carbone M, Mostocotto C, Mancone C, Tripodi M, Maione R, Amati P. Mitochondrial localization of PARP-1 requires interaction with mitofilin and is involved in the maintenance of mitochondrial DNA integrity. J Biol Chem. 2009; 284(46): 31616-24.
[50] Bai P, Cantó C, Oudart H, Brunyánszki A, Cen Y, Thomas C, Yamamoto H, Huber A, Kiss B, Houtkooper RH, Schoonjans K, Schreiber V, Sauve AA, Menissier-de Murcia J, Auwerx J. PARP-1 inhibition increases mitochondrial metabolism through SIRT1 activation. Cell Metab. 2011; 3(4): 461-468.
[51] Sampath H, Vartanian V, Rollins MR, Sakumi K, Nakabeppu Y, Lloyd RS. 8-Oxoguanine DNA glycosylase (OGG1) deficiency increases susceptibility to obesity and metabolic dysfunction. PLoS One. 2012; 7(12): e51697.
[52] Radicella JP, Dherin C, Desmaze C, Fox MS, Boiteux S. Cloning and characterization of hOGG1, a human homolog of the OGG1 gene of Saccharomyces cerevisiae. Proc Natl Acad Sci U S A. 1997; 94(15): 8010-8015.
[53] Nishioka K, Ohtsubo T, Oda H, Fujiwara T, Kang D, Sugimachi K, Nakabeppu Y. Expression and differential intracellular localization of two major forms of human 8-oxoguanine DNA glycosylase encoded by alternatively spliced OGG1 mRNAs. Mol Biol Cell. 1999; 10(5): 1637-1652.
[54] Bentinger M, Tekle M, Dallner G. Coenzyme Q – Biosynthesis and functions. Biochem Biophys Res Commun. 2010; 396(1): 74-79.
[55] Forsmark-Andree P, Dallner G, Ernster L. Endogenous ubiquinol prevents protein modification accompanying lipid peroxidation in beef heart submitochondrial particles. Free Radic Biol Med. 1995; 19(6): 749-757.
[56] Schniertshauer D, Müller S, Mayr T, Sonntag T, Gebhard D, Bergemann J. Accelerated Regeneration of ATP Level after Irradiation in Human Skin Fibroblasts by Coenzyme Q10. Photochem Photobiol. 2016; 92(3): 488-94.
[57] Tomasetti M, Alleva R, Borghi B, Collins AR. In vivo supplementation with coenzyme Q10 enhances the recovery of human lymphocytes from oxidative DNA damage. FASEB J. 2001; 15(8): 1425-1427.