Choroby mitochondriów, zwane też mitochondriopatiami, to choroby związane z uszkodzeniami mitochondriów. Ich przyczyna leży najczęściej w jądrze komórkowym oraz genomie wspomnianych organelli, tzw. mitochondrialnym DNA (mtDNA). Dziś wiemy, że źródłem wielu chorób są zaburzenia metabolizmu komórek, a w szczególności mitochondriów.
Mitochondriopatie
Jeśli takie defekty występują w około dwóch trzecich wszystkich mitochondriów w komórce, prowadzi to do niewystarczającego zaopatrzenia komórek w energię i można się spodziewać poważnych dysfunkcji mitochondriów i związanych z nimi chorób. Należą do nich cukrzyca, choroby układu krążenia, nowotwory i choroby neurodegeneracyjne związane z wiekiem, takie jak choroba Alzheimera i choroba Parkinsona – choroby, które dotykają głównie komórki cechujące się wysokim zapotrzebowaniem na energię, a w konsekwencji zwiększoną liczbą mitochondriów [1-3]. Pierwszymi oznakami utraty zdrowych, nienaruszonych mitochondriów mogą być problemy z pamięcią i koncentracją, spadek sprawności fizycznej, a także pogorszenie wzroku, węchu i słuchu. W momencie narodzin człowieka, tysiące kopii mtDNA w komórce są niemal identyczne. Natomiast pacjenci z zaburzeniami funkcji mitochondriów posiadają w każdej komórce ciała mieszaninę zmutowanego i dzikiego mtDNA [4,5]. Co więcej, również ilość zmutowanego DNA w obrębie narządów i tkanek tego samego osobnika bywa różna [6]. Zjawisko to wyjaśnia wysoką różnorodność fenotypów wśród pacjentów z dysfunkcjami mitochondriów [7]. Z 80% tlenu pobieranego przez ssaki, który jest wykorzystywany w mitochondriach, 1-2% ulega przekształceniu w reaktywne formy tlenu [8].
Reaktywne formy tlenu (ROS)
Skrót ROS oznacza związki tlenu cząsteczkowego, które są produktem ubocznym metabolizmu komórkowego [9]. Mają postać rodników, jonów lub cząsteczek, które na zewnętrznej powłoce elektronowej posiadają niesparowany elektron [10, 11]. Dzięki tym właściwościom związki te są wysoce reaktywne i agresywne chemicznie, dlatego mogą utleniać i uszkadzać komórkowe biopolimery – takie jak DNA, białka i lipidy [10-12]. Do grupy ROS należą rodnikowe ROS, takie jak wysoce reaktywny rodnik hydroksylowy (-OH) czy anion ponadtlenkowy (O2•¯), który uchodzi za prekursora niemal wszystkich ROS [13]. Nierodnikowe ROS są reprezentowane przez nadtlenek wodoru (H2O2), organiczny hydroksynadtlenek (ROOH) lub tlen singletowy (1O2). ROS występują we wszystkich organizmach tlenowych i ze względu na nieliniową zależność pomiędzy dawką a odpowiedzią, pełnią w niskich stężeniach ważne funkcje fizjologiczne, takie jak przekazywanie sygnałów w mózgu, natomiast w wysokich, patologicznych stężeniach przyczyniają się do rozwoju różnych chorób, takich jak stres oksydacyjny przy (mitohormezie) [9].
Mitochondria uchodzą zatem za główne źródło tych związków, a zwłaszcza mitochondrialnego nadtlenku (mtSO), związku chemicznego zawierającego anion ponadtlenkowy wywodzący się z tlenu. Ponieważ ROS i mtSO są głównie niepożądanymi produktami ubocznymi łańcucha oddechowego (Rys. 1), powstawanie tych agresywnych związków wykazuje korelację z syntezą adenozynotrójfosforanu (ATP) jako ostatniego etapu łańcucha oddechowego [8]. Zjawisko to jest powodowane wyciekiem elektronów pomiędzy kompleksem I i III [11, 14, 15]. Z uwagi na stosunkowo wysoką produkcję ROS w mitochondriach oraz fakt, że mtDNA jest bardziej wrażliwe na wpływ czynników zewnętrznych (w rodzaju ROS), ponieważ nie posiada osłony w postaci białek histonowych, informacja genetyczna zawarta w tych organellach ulega ok. 10-krotnie częściej uszkodzeniom oksydacyjnym niż jądrowe DNA, w którym wskaźnik mutacji przy braku wpływu czynników zewnętrznych wynosi około jednej wymiany nukleotydu na 1,0 x 109 par zasad w każdej rundzie replikacji [8, 16]. Ponadto uszkodzenia oksydacyjne mtDNA prowadzą do zwiększenia wycieku elektronów w łańcuchu oddechowym, a tym samym do zwiększenia liczby wolnych rodników, które z kolei przyczyniają się do dalszego wzrostu liczby mutacji, a tym samym do uszkodzenia mtDNA. W ten sposób powstaje „błędne koło” produkcji ROS w komórkach [17 – 20]. Zgodnie z „mitochondrialną teorią starzenia się” mitochondrialne reaktywne formy tlenu (mtROS) odgrywają wraz z innymi oksydacyjnymi uszkodzeniami mtDNA i ograniczoną zdolnością naprawczą mitochondriów [OM & Ernährung, 2018; SH08: 50 – 57] bardzo ważną rolę w procesach starzenia się i chorobach związanych z wiekiem [21 – 26]. Jednak konkretne szczegóły, takie jak dokładna ilość mtROS, pozostają przedmiotem kontrowersji [27, 28], pomimo że już w latach 80. i 90. wykazano, że to właśnie ROS poważnie uszkadzają mtDNA [29, 30]. W badaniach nad rozwojem mitochondriopatii główną uwagę skupiano dotąd na dziedziczeniu czynników genetycznych, lecz od pewnego czasu zaczęto uwzględniać również inne szkodliwe oddziaływania, takie jak wpływ czynników środowiskowych, np. promieniowania UV [OM & Ernährung, 2018; SH08: 50 – 57], ale także leków, jako czynników wyzwalających zaburzenia funkcji mitochondriów. Ponieważ zgodnie z teorią endosymbiozy mitochondria wywodzą się od bakterii, które zostały kiedyś wchłonięte przez komórki eukariotyczne, warto zwrócić uwagę na antybiotyki, ale także na chemioterapeutyki i metylofenidat, który np. blokuje kompleks I mitochondrialnego łańcucha oddechowego i tym sposobem nasila produkcję mtSO. Do uszkodzeń mitochondriów mogą również prowadzić w długofalowej perspektywie stany zapalne, którym zawsze towarzyszy uwalnianie ROS. Również cierpienie psychiczne prowadzi do uwalniania w naszym organizmie ROS i w konsekwencji do rozwoju stresu nerwowego, który z kolei może powodować zaburzenia funkcjonowania mitochondriów [31]. Obecność wysokiego stężenia ROS lub wzrost ich stężenia prowadzi do przesunięcia wewnątrzkomórkowej równowagi pomiędzy procesami utleniania i redukcji w kierunku procesów oksydacyjnych. Sprzyja to powstawaniu kolejnych ROS i uniemożliwia wystarczającą ilościowo inaktywację tych związków przez dostępne dla komórek przeciwutleniacze, co skutkuje jeszcze silniejszym przesunięciem równowagi [12]. Zakłócenie wewnątrzkomórkowej równowagi pomiędzy tworzeniem ROS a ich inaktywacją określamy mianem „stresu oksydacyjnego” [12, 32]. W celu przywrócenia tej równowagi od pewnego czasu proponuje się stosowanie substancji mitotropowych – substancji, które pozytywnie wpływają na funkcjonowanie mitochondriów.
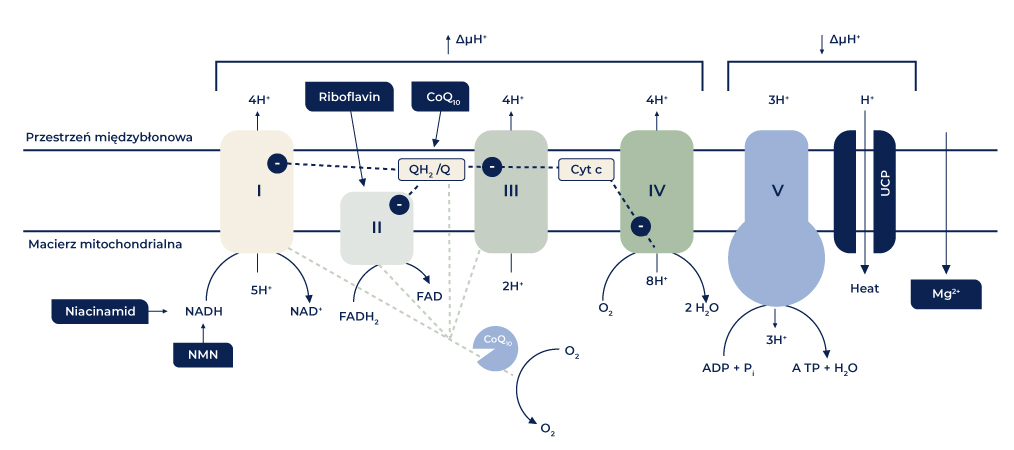
Ryc. 1: Uproszczony schemat mitochondrialnego łańcucha oddechowego. Przedstawiono na nim wewnętrzne błony mitochondrialne i poszczególne przedziały łańcucha oddechowego. Kompleksy I-IV wytwarzają gradient protonów (ΔμH+), który umożliwia za pośrednictwem kompleksu V (syntaza ATP) syntezę ATP. Elektrony wędrują z kompleksu I przez kompleks II i ubichinol do kompleksu III. Cytochrom C transportuje elektron z kompleksu III do kompleksu IV. Przedstawiono również wybrane mitoceutyki®, które wywierają bezpośredni wpływ na mitochondria.
Medycyna mitochondrialna
Medycyna mitochondrialna, która w ciągu ostatnich kilku lat zwróciła na siebie uwagę całej medycyny, skupia się między innymi na przywróceniu wewnątrzkomórkowej równowagi. Medycyna mitochondrialna stanowi nową formę terapii w wielu dziedzinach medycyny człowieka, będącą uzupełnieniem konwencjonalnych metod leczenia. Celem terapii mitochondrialnej jest wywarcie zdecydowanego wpływu na zaburzony metabolizm komórkowy pacjenta. Oprócz nowoczesnej i innowacyjnej diagnostyki, najważniejszymi narzędziami medycyny mitochondrialnej są tak zwane mitoceutyki®. Termin ten odnosi się do substancji mitotropowych, za pomocą których staramy się niwelować zakłócenia w funkcjonowaniu mitochondriów. Należą do nich m.in. nośniki elektronów/protonów, takie jak ubichinol/ubichinon (koenzym Q10; CoQ10), witaminy, a także minerały i pierwiastki śladowe, które i tak są naturalnym elementem składowym metabolizmu komórki. Środki te stosuje się zarówno profilaktycznie, jak i terapeutycznie w ramach leczenia towarzyszącego. Przy czym, znany nam CoQ10 stanowi obiecujący terapeutyczny punkt wyjścia, umożliwiający wpływanie na procesy wytwarzania ROS, a tym samym na utrzymywanie mitochondriów we wszystkich narządach w stanie pełnej funkcjonalności. Ze względu na swoje plejotropowe działanie (wiele mechanizmów działania uruchamianych przez jeden lek) CoQ10 ma ogromne znaczenie dla medycyny mitochondrialnej.
Mitoceutyki®
Termin ten, ukuty przez dr Franza Enzmanna, obejmuje szereg grup substancji mitotropowych, które mają wszechstronny potencjał i stanowią podstawę zarówno profilaktycznego, jak i terapeutycznego podejścia stosowanego w medycynie mitochondrialnej. Mają one działanie nieswoiste i docierają do wszystkich mitochondriów w organizmie. Znane mitoceutyki® obejmują:
Żadna inna substancja mitotropowa nie doczekała się w ostatnich latach tak wielu publikacji. Resweratrol jest wtórną substancją roślinną o właściwościach antyoksydacyjnych, należącą do grupy polifenoli, której fenolowe grupy hydroksylowe mają wysoki potencjał redoks. Podobnie jak CoQ10, resweratrol uszczelnia miejsca wycieku protonów i jednocześnie neutralizuje reaktywne rodniki tlenowe [33]. Co więcej, potrafi stymulować własne antyoksydacyjne systemy enzymatyczne organizmu, takie jak dysmutaza ponadtlenkowa (SOD) [34].
Spermidyna
Ta naturalnie występująca poliamina, dzięki swoim właściwościom antyoksydacyjnym i przeciwzapalnym, uczestniczy w wielu procesach molekularnych i komórkowych, w tym w indukowaniu autofagii, apoptozie, utrzymaniu stabilności DNA i metabolizmie mitochondriów [35, 36]. Wykazano, że suplementowanie egzogennej spermidyny łagodzi dysfunkcje związane z wiekiem. Spermidyna stymuluje też m.in. biogenezę mitochondriów poprzez szlak SIRT1/PGC-1α i wywiera działanie przeciwzapalne poprzez zależną od mitochondrialnych ROS aktywację AMPK (kinazy białkowej zależnej od AMP) [37, 38].
Witaminy B
Wiele witamin z grupy B to substancje mitotropowe – na przykład witamina B1 (tiamina), B2 (ryboflawina) i B3 (niacynamid). Do zadań tych związków, które są niezbędne dla organizmu człowieka, należy np. funkcja rozrusznika komórkowego metabolizmu węglowodanów, hamowanie glikozylacji białek oraz pobudzanie i przekazywanie bodźców w obwodowym układzie nerwowym przez tiaminę. Ryboflawina uczestniczy w metabolizmie komórkowym w postaci koenzymów flawinowych: dinukleotydu flawinowo-adeninowego (FAD) i mononukleotydu flawinowo-adeninowego (FAM). Koenzymy flawinowe odpowiadają za dziesiątki enzymatycznie katalizowanych reakcji utleniania i redukcji, dlatego są niezbędne dla wewnątrzkomórkowej równowagi oksydacyjnej. W zależności od ukierunkowania reakcji mogą one działać jako akceptory lub donory elektronów. Tak więc ryboflawina odgrywa istotną rolę w mitochondrialnym łańcuchu oddechowym. Ponadto bierze udział w metabolizmie innych witamin z grupy B, w tym w syntezie niacynamidu. Jako koenzym wchodzący w skład dinukleotydu nikotynamidoadeninowego (NAD) i fosforanu dinukleotydu nikotynamidoadeninowego (NADP), witamina ta uczestniczy w wielu reakcjach enzymatycznych związanych z przemianą materii, a przede wszystkim w procesie wytwarzania energii w mitochondriach. Współpracuje przy tym ściśle z CoQ10 [39].
NMN/NAD+
Mononukleotyd nikotynamidu (NMN) również należy do rodziny witamin B3. Cząsteczka ta jest bezpośrednim prekursorem NAD+ i bierze udział w biosyntezie NAD+ we wszystkich organizmach żywych. Z NMN powstaje dinukleotyd nikotynoamidoadeninowy (NADH), który w kompleksie I łańcucha oddechowego (Rys. 1) ulega ostatecznie przekształceniu w NAD+, utlenioną formę NAD. Związek ten jest potrzebny komórkom do regulacji genów, naprawy DNA i wytwarzania energii. Dzięki temu zwiększa żywotność komórek, redukując ich uszkodzenia i ograniczając apoptozę [40]. Podobnie jak spermidyna, NMN również stymuluje szlak SIRT1 [41].
Mg2+
Magnez jako minerał o zasadniczym znaczeniu jest niezbędny do sprawnego przebiegu wielu procesów biochemicznych. Fizjologiczne spektrum działania magnezu jest ogromne, ponieważ jest on zaangażowany w charakterze składnika lub kofaktora w kilkaset reakcji enzymatycznych. Wraz z CoQ10 i witaminami B2 i B3 odgrywa ważną rolę w mitochondrialnym łańcuchu oddechowym, gdzie aktywuje rozmaite enzymy. Na przykład, aktywacja tiaminy do koenzymatycznie aktywnego difosforanu tiaminy wymaga działania kinazy tiaminowej, która jest zależna od magnezu. Ponadto stabilizuje wytworzoną cząsteczkę ATP, która występuje głównie w postaci kompleksu z centralnie położonym jonem magnezu [39].
Koenzym Q10
CoQ10 jest wszechobecną endogenną pochodną chinonu, która występuje w błonach biologicznych większości komórek ciała oraz w krążących w organizmie lipoproteinach, gdzie pełni rolę składnika antyoksydacyjnego [3, 8]. Pod względem strukturalnym CoQ10 składa się z aktywnego redukcyjno-oksydacyjnie pierścienia 2,3-dimetoksy-5-metylobenzochinonu i izoprenoidowego łańcucha bocznego. W zależności od kolejności grup funkcyjnych przyłączonych do pierścienia chinonowego, można wyróżnić konformacje fizjologicznie nieistotne (izomer cis) oraz efektywne izomery (izomer trans) [42]. Liczba połączonych jednostek dihydroizoprenowych jest u różnych organizmów różna i waha się od sześciu do dziesięciu jednostek dihydroizoprenowych [3]. U ludzi łańcuch ten składa się głównie z dziesięciu monomerów, dlatego lipid ten nazywany jest też koenzymem Q10. Jedynie 7-9% tego koenzymu występuje w ludzkim organizmie w postaci koenzymu Q9 [8].
Pierścień 1,4-benzochinonu w ubichinonie i 1,4-benzohydrochinon w ubichinolu stanowią aktywną grupę funkcyjną lipidu. To właśnie ten redukcyjno-oksydacyjnie aktywny element struktury przyjmuje i uwalnia elektrony podczas procesów redukcji i utleniania. Oprócz właściwości antyoksydacyjnych, lipofilny boczny łańcuch izoprenoidowy służy do zakotwiczenia koenzymu w błonach biologicznych, zwiększając tym sposobem ich płynność i przepuszczalność [8]. Przeważająca w organizmie zredukowana forma koenzymu Q10 czyli ubichinol (CoQH2) pełni funkcję przeciwutleniacza, zapobiegając utlenianiu DNA, lipidów i białek [43]. Koenzym Q10, który jest utleniany do ubichinonu (CoQ), ulega nieustannemu powrotnemu enzymatycznemu przekształcaniu do swojej zredukowanej formy CoQH2, co pozwala mu zachować właściwości antyoksydacyjne [3]. Dzięki temu koenzym Q10 zawarty w osoczu krwi składa się zazwyczaj w 95% z CoQH2 i w około 5% z CoQ [44].
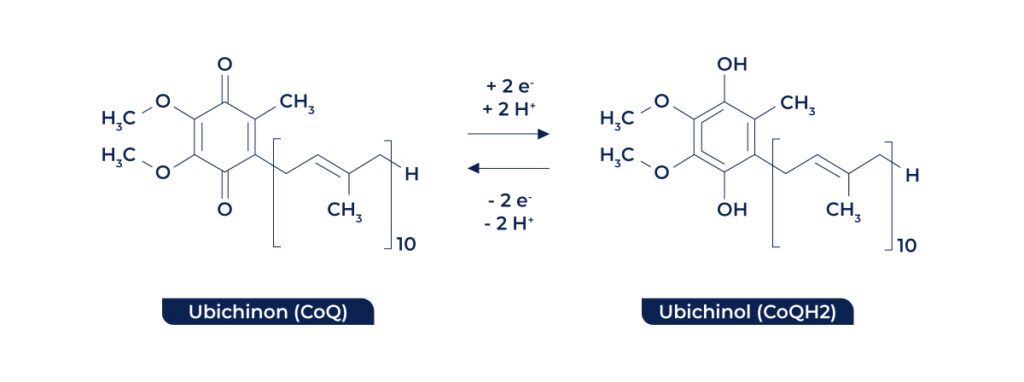
Rys. 2 Struktury chemiczne utlenionej i zredukowanej postaci CoQ10. Na rysunku przedstawiono utlenioną (CoQ) i zredukowaną (CoQH2) postać koenzymu oraz odpowiednie reakcje redoks. Część chinonową CoQ (1,4-benzochinon) i część hydrochinonową CoQH2 (1,4-benzohydrochinon) zaznaczono kolorem niebieskim.
Dr. rer. nat. Daniel Schniertshauer, Prof. Dr. rer. nat. Jörg Bergemann. Hochschule Albstadt-Sigmaringen. Biomedical Sciences. Anton-Günther-Straße 51.72488 Sigmaringen | Deutschland
Bibliografia:
[1] Krutmann J, Schroeder P. Role of mitochondria in photoaging of human skin: the defective powerhouse model. J Investig Dermatol Symp Proc. 2009 Aug;14(1):44-9. doi: 10.1038/jidsymp.2009.1. PMID: 19675552.
[2] Prinzinger R. Programmed ageing: the theory of maximal metabolic scope. How does the biological clock tick? EMBO Rep. 2005 Jul;6 Spec No(Suppl 1):S14-9. doi: 10.1038/sj.embor.7400425 . PMID: 15995655; PMCID: PMC1369273.
[3] Bentinger M, Tekle M, Dallner G. Coenzyme Q–biosynthesis and functions. Biochem Biophys Res Commun. 2010 May 21;396(1):74-9. doi: 10.1016/j.bbrc.2010.02.147. PMID: 20494114.
[4] Holt IJ, Harding AE, Morgan-Hughes JA. Deletions of muscle mitochondrial DNA in patients with mitochondrial myopathies. Nature. 1988 Feb 25;331(6158):717-9. doi: 10.1038/331717a0. PMID: 2830540.
[5] Holt IJ, Harding AE, Petty RK, Morgan-Hughes JA. A new mitochondrial disease associated with mitochondrial DNA heteroplasmy. Am J Hum Genet. 1990 Mar;46(3):428-33. PMID: 2137962; PMCID: PMC1683641.
[6] Macmillan C, Lach B, Shoubridge EA. Variable distribution of mutant mitochondrial DNAs (tRNA(Leu[3243])) in tissues of symptomatic relatives with MELAS: the role of mitotic segregation. Neurology. 1993 Aug;43(8):1586-90. doi: 10.1212/wnl.43.8.1586. PMID: 8351017.
[7] Koopman WJ, Willems PH, Smeitink JA. Monogenic mitochondrial disorders. N Engl J Med. 2012 Mar 22;366(12):1132-41. doi: 10.1056/NEJMra1012478. PMID: 22435372.
[8] Turunen M, Olsson J, Dallner G. Metabolism and function of coenzyme Q. Biochim Biophys Acta. 2004 Jan 28;1660(1-2):171-99. doi: 10.1016/j.bbamem.2003.11.012 . PMID: 14757233.
[9] Yang S, Lian G. ROS and diseases: role in metabolism and energy supply. Mol Cell Biochem. 2020 Apr;467(1-2):1-12. doi: 10.1007/s11010-019-03667-9 . Epub 2019 Dec 7. Erratum in: Mol Cell Biochem. 2020 Feb 17; PMID: 31813106; PMCID: PMC7089381.
[10] Krokan HE, Bjørås M. Base excision repair. Cold Spring Harb Perspect Biol. 2013 Apr 1;5(4):a012583. doi: 10.1101/cshperspect.a012583 . PMID: 23545420; PMCID: PMC3683898.
[11] Liou GY, Storz P. Reactive oxygen species in cancer. Free Radic Res. 2010 May;44(5):479-96. doi: 10.3109/10715761003667554 . PMID: 20370557; PMCID: PMC3880197.
[12] Birben E, Sahiner UM, Sackesen C, Erzurum S, Kalayci O. Oxidative stress and antioxidant defense. World Allergy Organ J. 2012 Jan;5(1):9-19. doi: 10.1097/WOX.0b013e3182439613 . Epub 2012 Jan 13. PMID: 23268465; PMCID: PMC3488923.
[13] Lambert AJ, Brand MD. Reactive oxygen species production by mitochondria. Methods Mol Biol. 2009;554:165-81. doi: 10.1007/978-1-59745-521-3_11. PMID: 19513674.
[14] Bottje WG. Oxidative metabolism and efficiency: the delicate balancing act of mitochondria. Poult Sci. 2019 Oct 1;98(10):4223-4230. doi: 10.3382/ps/pey405. PMID: 30371897.
[15] Hunte C, Zickermann V, Brandt U. Functional modules and structural basis of conformational coupling in mitochondrial complex I. Science. 2010 Jul 23;329(5990):448-51. doi: 10.1126/science.1191046 . Epub 2010 Jul 1. PMID: 20595580.
[16] Wirth CJ, Zichner L. Knippers R. Orthopädie und orthopädische Chirurgie: Stoffwechel- und Systemerkrankungen. Georg Thieme Verlag. 2003. ISBN 9783131269317.
[17] Furda AM, Marrangoni AM, Lokshin A, Van Houten B. Oxidants and not alkylating agents induce rapid mtDNA loss and mitochondrial dysfunction. DNA Repair (Amst). 2012 Aug 1;11(8):684-92. doi: 10.1016/j.dnarep.2012.06.002 . Epub 2012 Jul 4. PMID: 22766155; PMCID: PMC3878289.
[18] Yoshida T, Goto S, Kawakatsu M, Urata Y, Li TS. Mitochondrial dysfunction, a probable cause of persistent oxidative stress after exposure to ionizing radiation. Free Radic Res. 2012 Feb;46(2):147-53. doi: 10.3109/10715762.2011.645207 . Epub 2012 Jan 12. PMID: 22126415.
[19] Chinnery PF, Elliott HR, Hudson G, Samuels DC, Relton CL. Epigenetics, epidemiology and mitochondrial DNA diseases. Int J Epidemiol. 2012 Feb;41(1):177-87. doi: 10.1093/ije/dyr232 . Epub 2012 Jan 28. PMID: 22287136; PMCID: PMC3304530.
[20] DeBalsi KL, Hoff KE, Copeland WC. Role of the mitochondrial DNA replication machinery in mitochondrial DNA mutagenesis, aging and age-related diseases. Ageing Res Rev. 2017 Jan;33:89-104. doi: 10.1016/j.arr.2016.04.006 . Epub 2016 Apr 30. PMID: 27143693; PMCID: PMC5086445.
[21] Damian MS, Ellenberg D, Gildemeister R, Lauermann J, Simonis G, Sauter W, Georgi C. Coenzyme Q10 combined with mild hypothermia after cardiac arrest: a preliminary study. Circulation. 2004 Nov 9;110(19):3011-6. doi: 10.1161/01.CIR.0000146894.45533.C2. Epub 2004 Nov 1. PMID: 15520321.
[22] Harman D. The biologic clock: the mitochondria? J Am Geriatr Soc. 1972 Apr;20(4):145-7. doi: 10.1111/j.1532-5415.1972.tb00787.x. PMID: 5016631.
[23] Hazane F, Sauvaigo S, Douki T, Favier A, Beani JC. Age-dependent DNA repair and cell cycle distribution of human skin fibroblasts in response to UVA irradiation. J Photochem Photobiol B. 2006 Mar 1;82(3):214-23. doi: 10.1016/j.jphotobiol.2005.10.004. Epub 2006 Feb 7. PMID: 16460955.
[24] Prahl S, Kueper T, Biernoth T, Wöhrmann Y, Münster A, Fürstenau M, Schmidt M, Schulze C, Wittern KP, Wenck H, Muhr GM, Blatt T. Aging skin is functionally anaerobic: importance of coenzyme Q10 for anti aging skin care. Biofactors. 2008;32(1-4):245-55. doi: 10.1002/biof.5520320129. PMID: 19096122.
[25] Sauvaigo S, Bonnet-Duquennoy M, Odin F, Hazane-Puch F, Lachmann N, Bonté F, Kurfürst R, Favier A. DNA repair capacities of cutaneous fibroblasts: effect of sun exposure, age and smoking on response to an acute oxidative stress. Br J Dermatol. 2007 Jul;157(1):26-32. doi: 10.1111/j.1365-2133.2007.07890.x. PMID: 17578435.
[26] Wei YH, Wu SB, Ma YS, Lee HC. Respiratory function decline and DNA mutation in mitochondria, oxidative stress and altered gene expression during aging. Chang Gung Med J. 2009 Mar-Apr;32(2):113-32. PMID: 19403001.
[27] Lagouge M, Larsson NG. The role of mitochondrial DNA mutations and free radicals in disease and ageing. J Intern Med. 2013 Jun;273(6):529-43. doi: 10.1111/joim.12055 . Epub 2013 Mar 7. PMID: 23432181; PMCID: PMC3675642.
[28] Grivennikova VG, Vinogradov AD. Mitochondrial production of reactive oxygen species. Biochemistry (Mosc). 2013 Dec;78(13):1490-511. doi: 10.1134/S0006297913130087. PMID: 24490736.
[29] Richter C, Park JW, Ames BN. Normal oxidative damage to mitochondrial and nuclear DNA is extensive. Proc Natl Acad Sci U S A. 1988 Sep;85(17):6465-7. doi: 10.1073/pnas.85.17.6465. PMID: 3413108; PMCID: PMC281993.
[30] Yakes FM, Van Houten B. Mitochondrial DNA damage is more extensive and persists longer than nuclear DNA damage in human cells following oxidative stress. Proc Natl Acad Sci U S A. 1997 Jan 21;94(2):514-9. doi: 10.1073/pnas.94.2.514. PMID: 9012815; PMCID: PMC19544.
[31] Mutschler R. Regenerative Mitochondrien-Medizin – von der Forschung in die Praxis. Orthomol. Med. 2012 Mar;3:20-22
[32] Sies H. Oxidative stress: a concept in redox biology and medicine. Redox Biol. 2015;4:180-3. doi: 10.1016/j.redox.2015.01.002. Epub 2015 Jan 3. PMID: 25588755; PMCID: PMC4309861.
[33] Leonard SS, Xia C, Jiang BH, Stinefelt B, Klandorf H, Harris GK, Shi X. Resveratrol scavenges reactive oxygen species and effects radical-induced cellular responses. Biochem Biophys Res Commun. 2003 Oct 3;309(4):1017-26. doi: 10.1016/j.bbrc.2003.08.105. PMID: 13679076.
[34] Martinez J, Moreno JJ. Effect of resveratrol, a natural polyphenolic compound, on reactive oxygen species and prostaglandin production. Biochem Pharmacol. 2000 Apr 1;59(7):865-70. doi: 10.1016/s0006-2952(99)00380-9. PMID: 10718345.
[35] Partridge L, Fuentealba M, Kennedy BK. The quest to slow ageing through drug discovery. Nat Rev Drug Discov. 2020 Aug;19(8):513-532. doi: 10.1038/s41573-020-0067-7. Epub 2020 May 28. PMID: 32467649.
[36] Ren J, Zhang Y. Targeting Autophagy in Aging and Aging-Related Cardiovascular Diseases. Trends Pharmacol Sci. 2018 Dec;39(12):1064-1076. doi: 10.1016/j.tips.2018.10.005 . Epub 2018 Oct 26. PMID: 30458935; PMCID: PMC6251315.
[37] Wang J, Li S, Wang J, Wu F, Chen Y, Zhang H, Guo Y, Lin Y, Li L, Yu X, Liu T, Zhao Y. Spermidine alleviates cardiac aging by improving mitochondrial biogenesis and function. Aging (Albany NY). 2020 Jan 6;12(1):650-671. doi: 10.18632/aging.102647. Epub 2020 Jan 6. PMID: 31907336; PMCID: PMC6977682.
[38] Liu R, Li X, Ma H, Yang Q, Shang Q, Song L, Zheng Z, Zhang S, Pan Y, Huang P, Fang J, Li Y, Liu Z, Cao L, Feng C, Gong Z, Chen Y, Wang Y, Melino G, Shao C, Shi Y. Spermidine endows macrophages anti-inflammatory properties by inducing mitochondrial superoxide-dependent AMPK activation, Hif-1α upregulation and autophagy. Free Radic Biol Med. 2020 Dec;161:339-350. doi: 10.1016/j.freeradbiomed.2020.10.029 . Epub 2020 Oct 24. PMID: 33122005.
[39] Enzmann F. Das MitoMed-Konzept – mse Pharmazeutika GmbH. Abgerufen am 08. Januar 2022 von https://www.mse-pharma.de/mitomed-konzept/
[40] Pu Q, Guo XX, Hu JJ, Li AL, Li GG, Li XY. Nicotinamide mononucleotide increases cell viability and restores tight junctions in high-glucose-treated human corneal epithelial cells via the SIRT1/Nrf2/HO-1 pathway. Biomed Pharmacother. 2022 Feb 2;147:112659. doi: 10.1016/j.biopha.2022.112659. Epub ahead of print. PMID: 35123232.
[41] Liu X, Li D, Liu Z, Song Y, Zhang B, Zang Y, Zhang W, Niu Y, Shen C. Nicotinamide mononucleotide promotes pancreatic islet function through the SIRT1 pathway in mice after severe burns. Burns. 2022 Jan 20:S0305-4179(22)00015-8. doi: 10.1016/j.burns.2022.01.013. Epub ahead of print. PMID: 35123833.
[42] Crane FL. Biochemical functions of coenzyme Q10. J Am Coll Nutr. 2001 Dec;20(6):591-8. doi: 10.1080/07315724.2001.10719063. PMID: 11771674.
[43] Tomasetti M, Alleva R, Borghi B, Collins AR. In vivo supplementation with coenzyme Q10 enhances the recovery of human lymphocytes from oxidative DNA damage. FASEB J. 2001 Jun;15(8):1425-7. doi: 10.1096/fj.00-0694fje. PMID: 11387245.
[44] Evans M, Baisley J, Barss S, Guthrie N. A randomized, double-blind trial on the bioavailability of two CoQ10 formulations. J of Functional Foods. 2009:65-73. doi: 10.1016/j.jff.2008.09.010.
[45] Mitchell P. Protonmotive redox mechanism of the cytochrome b-c1 complex in the respiratory chain: protonmotive ubiquinone cycle. FEBS Lett. 1975 Aug 1;56(1):1-6. doi: 10.1016/0014-5793(75)80098-6. PMID: 239860.
[46] Lenaz G, Genova ML. Mobility and function of coenzyme Q (ubiquinone) in the mitochondrial respiratory chain. Biochim Biophys Acta. 2009 Jun;1787(6):563-73. doi: 10.1016/j.bbabio.2009.02.019. Epub 2009 Mar 4. PMID: 19268424.
[47] Estornell E, Fato R, Castelluccio C, Cavazzoni M, Parenti Castelli G, Lenaz G. Saturation kinetics of coenzyme Q in NADH and succinate oxidation in beef heart mitochondria. FEBS Lett. 1992 Oct 19;311(2):107-9. doi: 10.1016/0014-5793(92)81378-y. PMID: 1327877.
[48] Littarru GP, Tiano L. Bioenergetic and antioxidant properties of coenzyme Q10: recent developments. Mol Biotechnol. 2007 Sep;37(1):31-7. doi: 10.1007/s12033-007-0052-y. PMID: 17914161.
[49] Schniertshauer D, Müller S, Mayr T, Sonntag T, Gebhard D, Bergemann J. Accelerated Regeneration of ATP Level after Irradiation in Human Skin Fibroblasts by Coenzyme Q10. Photochem Photobiol. 2016 May;92(3):488-94. doi: 10.1111/php.12583. Epub 2016 Apr 18. PMID: 26946184.
[50] Schniertshauer D, Gebhard D, Bergemann J. Age-Dependent Loss of Mitochondrial Function in Epithelial Tissue Can Be Reversed by Coenzyme Q10. J Aging Res. 2018 Sep 5;2018:6354680. doi: 10.1155/2018/6354680. PMID: 30254763; PMCID: PMC6145312.
[51] Bentinger M, Brismar K, Dallner G. The antioxidant role of coenzyme Q. Mitochondrion. 2007 Jun;7 Suppl:S41-50. doi: 10.1016/j.mito.2007.02.006. Epub 2007 Mar 16. PMID: 17482888.
[52] Nordman T, Xia L, Björkhem-Bergman L, Damdimopoulos A, Nalvarte I, Arnér ES, Spyrou G, Eriksson LC, Björnstedt M, Olsson JM. Regeneration of the antioxidant ubiquinol by lipoamide dehydrogenase, thioredoxin reductase and glutathione reductase. Biofactors. 2003;18(1-4):45-50. doi: 10.1002/biof.5520180206. PMID: 14695919.
[53] Schniertshauer D, Gebhard D, van Beek H, Nöth V, Schon J, Bergemann J. The activity of the DNA repair enzyme hOGG1 can be directly modulated by ubiquinol. DNA Repair (Amst). 2020 Mar;87:102784. doi: 10.1016/j.dnarep.2019.102784. Epub 2020 Jan 3. PMID: 31923624.
[54] Su YH, Lee YL, Chen SF, Lee YP, Hsieh YH, Tsai JH, Hsu JL, Tian WT, Huang W. Essential role of β-human 8-oxoguanine DNA glycosylase 1 in mitochondrial oxidative DNA repair. Environ Mol Mutagen. 2013 Jan;54(1):54-64. doi: 10.1002/em.21742. Epub 2012 Oct 11. PMID: 23055259.
[55] Edeas M. Strategies to target mitochondria and oxidative stress by antioxidants: key points and perspectives. Pharm Res. 2011 Nov;28(11):2771-9. doi: 10.1007/s11095-011-0587-2. Epub 2011 Sep 15. PMID: 21918914.
[56] Perumal SS, Shanthi P, Sachdanandam P. Augmented efficacy of tamoxifen in rat breast tumorigenesis when gavaged along with riboflavin, niacin, and CoQ10: effects on lipid peroxidation and antioxidants in mitochondria. Chem Biol Interact. 2005 Feb 28;152(1):49-58. doi: 10.1016/j.cbi.2005.01.007. PMID: 15766922.
[57] Echtay KS, Winkler E, Klingenberg M. Coenzyme Q is an obligatory cofactor for uncoupling protein function. Nature. 2000 Nov 30;408(6812):609-13. doi: 10.1038/35046114. PMID: 11117751.
[58] Echtay KS, Winkler E, Frischmuth K, Klingenberg M. Uncoupling proteins 2 and 3 are highly active H(+) transporters and highly nucleotide sensitive when activated by coenzyme Q (ubiquinone). Proc Natl Acad Sci U S A. 2001 Feb 13;98(4):1416-21. doi: 10.1073/pnas.98.4.1416. PMID: 11171965; PMCID: PMC29271.
[59] Nedergaard J, Ricquier D, Kozak LP. Uncoupling proteins: current status and therapeutic prospects. EMBO Rep. 2005 Oct;6(10):917-21. doi: 10.1038/sj.embor.7400532. PMID: 16179945; PMCID: PMC1369193.
[60] Zhou X, Zhuang Z, Wang W, He L, Wu H, Cao Y, Pan F, Zhao J, Hu Z, Sekhar C, Guo Z. OGG1 is essential in oxidative stress induced DNA demethylation. Cell Signal. 2016 Sep;28(9):1163-71. doi: 10.1016/j.cellsig.2016.05.021. Epub 2016 May 29. PMID: 27251462.
[61] Beal MF. Mitochondrial dysfunction and oxidative damage in Alzheimer’s and Parkinson’s diseases and coenzyme Q10 as a potential treatment. J Bioenerg Biomembr. 2004 Aug;36(4):381-6. doi: 10.1023/B:JOBB.0000041772.74810.92. PMID: 15377876.
[62] Blasi MA, Bovina C, Carella G, Genova ML, Jansen AM, Lenaz G, Brancato R. Does coenzyme Q10 play a role in opposing oxidative stress in patients with age-related macular degeneration? Ophthalmologica. 2001 Jan-Feb;215(1):51-4. doi: 10.1159/000050826. PMID: 11125270.
[63] Chen RS, Huang CC, Chu NS. Coenzyme Q10 treatment in mitochondrial encephalomyopathies. Short-term double-blind, crossover study. Eur Neurol. 1997;37(4):212-8. doi: 10.1159/000117445. PMID: 9208260.
[64] Damian MS, Ellenberg D, Gildemeister R, Lauermann J, Simonis G, Sauter W, Georgi C. Coenzyme Q10 combined with mild hypothermia after cardiac arrest: a preliminary study. Circulation. 2004 Nov 9;110(19):3011-6. doi: 10.1161/01.CIR.0000146894.45533.C2. Epub 2004 Nov 1. PMID: 15520321.