W obliczu tak wszechstronnych właściwości CoQ10 nie dziwi fakt, że wywołuje on szereg efektów na poziomie komórkowym i że koenzym pełni dzięki temu rozliczne funkcje w ludzkim organizmie.
Rola koenzymu Q10 w metabolizmie energetycznym komórek eukariotycznych
Ze względu na swój potencjał redoks czyli zdolność do transportowania zarówno protonów, jak i elektronów w reakcjach redoks, CoQ10 odgrywa kluczową rolę w procesie funkcjonowania mitochondrialnego łańcucha oddechowego. Lipid ten, znajdujący się w wewnętrznej błonie mitochondrialnej, funkcjonuje jako system transportowy, który przenosi elektrony z kompleksów I i II przez hydrofobowe wnętrze błony do kompleksu III łańcucha oddechowego [3]. CoQ ulega zredukowaniu do ubichinolu CoQH2 poprzez przyjęcie dwóch elektronów i dwóch protonów. W przeciwnym kierunku CoQH2 może zostać utleniony do CoQ przez oddanie dwóch elektronów i protonów (Rys. 2). Ta para reakcji redoks reprezentuje cykl Q i odzwierciedla rolę CoQ10 jako nośnika elektronów. Również pozamitochondrialny transport elektronów (np. w lizosomach) odbywa się za pośrednictwem tego koenzymu [8]. Pierwszym etapem jest przeniesienie elektronów pochodzących z komórkowych równoważników redoks NADH i formy hydrochinonowej dinukleotydów flawinoadeninowych (FADH2) przez kompleks I lub kompleks II na CoQ. CoQH2 przekazuje następnie elektrony za pośrednictwem enzymu oksydoreduktazy ubichinon-cytochrom c (kompleks III) na cytochrom c. Tym sposobem przepływ elektronów zostaje wykorzystany do pompowania protonów z macierzy mitochondrialnej do przestrzeni międzybłonowej w celu wytworzenia elektrochemicznego gradientu protonów w poprzek wewnętrznej błony mitochondrialnej. Gradient ten służy do wytwarzania ATP przy udziale kompleksu V (Rys. 1) [45]. Ponieważ dyfuzja CoQ10 jest znacznie szybsza niż jego przemiana w kompleksach oddechowych, CoQ10 zachowuje się jak ruchoma, dyfundująca pula CoQ10 w obrębie wewnętrznej błony mitochondrialnej [46].
Przyjmuje się, że podanie dodatkowej dawki CoQ10 zwiększa wydajność transportu elektronów, a tym samym przyczynia się do poprawy parametrów oddechowych. Korelacja pomiędzy stężeniem CoQ10 a wydajnością oddychania została już opisana w literaturze, co pozwala przypuszczać, że samo fizjologiczne stężenie CoQ10 nie wystarcza do nasycenia łańcucha oddechowego [47, 48]. Spodziewano się więc, że suplementowanie CoQ10 może poprawiać wydajność oddychania mitochondrialnego. Badania wykazały, że CoQ10 jest w stanie utrzymać potencjał błon mitochondrialnych w sytuacji krótkotrwałych uszkodzeń powodowanych działaniem promieniowania UVA, zmniejszać skalę dysfunkcji mitochondriów i doprowadzać tym samym do szybszej regeneracji metabolizmu energetycznego w ludzkich fibroblastach [49]. Poprawę parametrów mitochondrialnych udało się wykazać nie tylko na poziomie komórkowym po naświetlaniu promieniami UV, ale także w pomiarach tych samych parametrów wykonanych bezpośrednio na bioptatach ludzkiej tkanki nabłonkowej.
Zaobserwowano, że wraz z wiekiem dawcy maleje wydajność oddychania mitochondrialnego o około 10% na dekadę oraz oddychanie związane z ATP, co jest zgodne z „mitochondrialną teorią starzenia się”. Jednak kiedy do bioptatów dodano zredukowaną formę CoQ10 czyli ubichinol, następowała regeneracja oddychania mitochondrialnego oraz prawie wszystkich głównych biomarkerów łańcucha oddechowego (Rys. 3) [50]. Fakt, że zaobserwowano znaczący wpływ podawanego CoQ10 na parametry oddechowe, sugeruje, że jest to w pierwszym rzędzie spowodowane zwiększeniem wydajności łańcucha transportu elektronów. Podejrzewa się, że egzogennie dostarczany CoQ10 przeciwdziała powstawaniu ewentualnego wąskiego gardła (tzw. zacisku elektronów) w migracji elektronów w kompleksie I/II i III, a tym samym poprawia transport pomiędzy kompleksami.
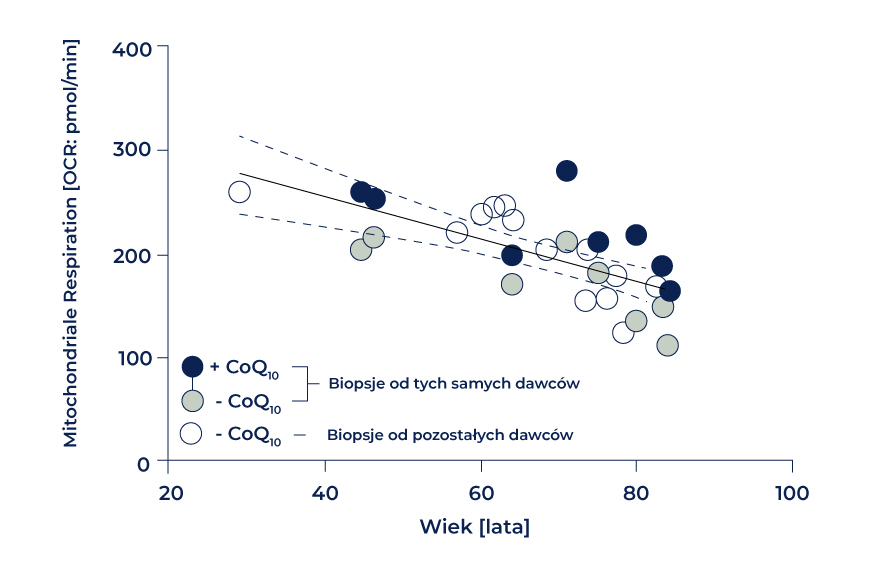
Analiza profilu oddechowego w bioptatach tkanki nabłonkowej pobranej od ludzkich dawców, z dodatkiem lub bez dodatku CoQ10. Białe i szare kółka reprezentują próbki niepoddane działaniu CoQ10. Próbki, które potraktowano koenzymem Q10, są zaznaczone na niebiesko. Połączone okręgi reprezentują próbki od tego samego dawcy. Rysunek opracowany na podstawie modelu zamieszczonego w pracy Schniertshauer i wsp., 2018. Oś x – wiek [lata]Oś y – oddychanie mitochondrialne [OCR: pmol/min]– bioptaty od tych samych dawców– bioptaty od pozostałych dawców
Rola koenzymu Q10 w zapobieganiu stresowi oksydacyjnemu / uszkodzeniom oksydacyjnym
CoQ10 odgrywa szczególnie ważną rolę w systemie antyoksydacyjnym ludzkiego organizmu, ponieważ oprócz karotenoidów, estrogenów i tokoferoli, czyli przeciwutleniaczy pochodzenia naturalnego, jest jedynym rozpuszczalnym w tłuszczach przeciwutleniaczem, który organizm może wytworzyć samodzielnie czyli endogennie [3, 8, 51]. Realizując funkcję przeciwutleniacza, zredukowana forma CoQH2 skutecznie zapobiega utlenianiu DNA, lipidów i białek [43]. Wyjątkowa skuteczność CoQH2 jako przeciwutleniacza wynika z licznych mechanizmów komórkowych służących do regeneracji CoQH2 i lokalizacji CoQ10 [3]. Ponieważ ROS uszkadzające komórkę powstają głównie w wewnętrznych błonach mitochondriów, zlokalizowany tam CoQH2 może przechwytywać powstające utleniacze bezpośrednio w miejscu ich powstawania, neutralizować je w procesach redukcji i chronić w ten sposób struktury komórkowe przed uszkodzeniami oksydacyjnymi [3,8]. Jego właściwościom antyoksydacyjnym przypisuje się również zdolność do hamowania inicjacji i rozprzestrzeniania się peroksydacji lipidów (rodnikowego utleniania nienasyconych kwasów tłuszczowych) [51]. Regeneracja utlenionego w tych reakcjach CoQH2 zachodzi poza wewnętrzną błoną mitochondrialną przy udziale enzymów: dehydrogenazy lipoamidowej (LipDH), reduktazy glutationowej (GR) i reduktazy tioredoksyny 1 (TrxR-1) w reakcjach zależnych od cynku i selenu (Rys. 4) [52].
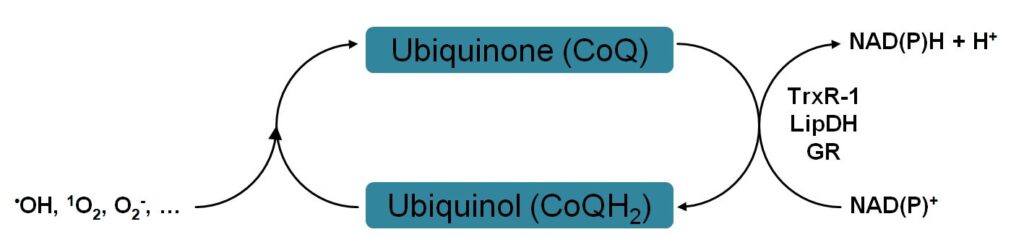
Regeneracja ubichinolu (CoQH2) po utlenieniu przez reaktywne formy tlenu (ROS) z udziałem enzymów: dehydrogenazy lipoamidowej (LipDH), reduktazy glutationowej (GR) i reduktazy tioredoksyny 1 (TrxR-1) zachodzi w reakcjach zależnych od cynku i selenu.
Jednym z najczęstszych uszkodzeń oksydacyjnych mtDNA jest utlenienie guaniny do 7,8-dihydro-8-oksoguaniny. Nagromadzenie tych i innych uszkodzeń DNA może prowadzić do zaburzeń w funkcjonowaniu łańcucha transportu elektronów, a ostatecznie do dysfunkcji mitochondriów. Ponieważ oprócz generowania ROS, w grę wchodzi też wiele czynników egzogennych, takich jak promieniowanie UV (OM & Ernährung. 2018; SH08: 50-57), które indukują powstawanie właśnie takich uszkodzeń, naprawa wszystkich uszkodzonych oksydacyjnie zasad guaninowych w wystarczającym zakresie często bywa już niemożliwa, zwłaszcza w zaawansowanym wieku. Udowodniono, że strukturalne właściwości CoQ10 prowadzą do zwiększenia aktywności enzymu odpowiedzialnego za naprawę tych uszkodzeń, a mianowicie – ludzkiej glikozylazy 8-oksoguaniny DNA 1 (hOGG1) ( Rys. 5) [53]. W procesie tym dochodzi do zmiany dwufunkcyjności wspomnianego enzymu oraz do bezpośredniej interakcji pomiędzy CoQ10 a glikozylazą 8-oksoguaniny DNA 1 [53]. Interakcje pomiędzy hOGG1 a innymi białkami zostały już udowodnione wcześniej. I tak np. hOGG1 wchodzi w kompleksie I łańcucha oddechowego w interakcję z mitochondrialnym białkiem NDUFB10 (NADH dehydrogenase [ubiquinone] 1 beta subcomplex subunit 10) [54].
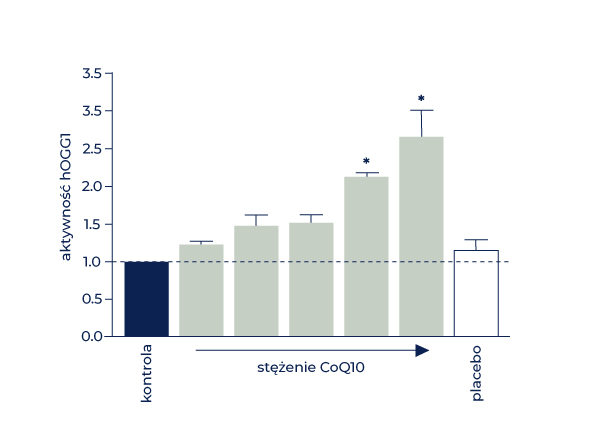
Enzym hOGG1, wyizolowany z lizatów mitochondriów pochodzących z ludzkich fibroblastów, poddano działaniu CoQ10 w różnych stężeniach oraz placebo. Rysunek opracowano na wzór modelu zamieszczonego w publikacji Schniertshauer i wsp., 2020. Oś x – stężenie CoQ10 CTRL – kontrola Oś y – aktywność hOGG1
Ponadto zakłada się, że suplementowanie CoQ10 wspomaga aktywność innych enzymów, które przyczyniają się do neutralizacji ROS, w tym dysmutazy ponadtlenkowej (SOD) i dehydrogenazy glutaminianowej (GDH). Enzymy te, które są obecne głównie w mitochondriach, wymagają do neutralizacji ROS kofaktorów w postaci przeciwutleniaczy [55]. Wzrost poziomu tych enzymów wykryto w komórkach rakowych szczurów podczas terapii tamoksyfenem po podaniu dodatkowo CoQ10 [56].
Kolejny sposób, w jaki koenzym Q10 może oddziaływać na ROS powstające w następstwie stresu oksydacyjnego, ma związek z tzw. białkami rozprzęgającymi (uncoupling proteins, UCPs). CoQ10 działa jako kofaktor dla mitochondrialnych UCP, uczestnicząc w ten sposób w zapobieganiu nadmiernej produkcji mtROS [57, 58]. Za utrzymywanie niskiego poziomu ROS odpowiadają w szczególności białka UCP2 i UCP3. Aktywacja tych białek prowadzi do rozprzęgnięcia fosforylacji oksydacyjnej, a tym samym do zmniejszenia gradientu protonów w poprzek wewnętrznej błony mitochondrialnej. Dzięki temu powstaje mniej ROS i tym samym maleje prawdopodobieństwo interakcji elektronów z tlenem [59]. UPC ulegają stymulacji przez aktywatory, które zwykle składają się z samych ROS [8]. Opisany mechanizm ujemnego sprzężenia zwrotnego stanowi mechanizm regulacyjny, który przeciwdziała nadprodukcji ROS [59].
Podsumowanie
Ze względu na swoje właściwości plejotropowe, CoQ10, wraz z innymi mitoceutykami®, stanowi ważny filar medycyny mitochondrialnej. Udało się wykazać, że oprócz wspomagania naprawy krótkotrwałych uszkodzeń wywołanych promieniowaniem UV, CoQ10 ma także korzystny wpływ na eliminowanie uszkodzeń wywołanych długotrwałym działaniem czynników zewnętrznych i wiekiem. W badaniach ex vivo na próbkach ludzkiego naskórka wykazano spadek oddychania mitochondrialnego i produkcji ATP związany z wiekiem dawcy, co odpowiada „mitochondrialnej teorii starzenia się”. Ten spadek można ograniczyć poprzez podawanie CoQ10 [49, 50]. Co więcej, wykazano bezpośrednią interakcję pomiędzy CoQ10 a hOGG1, enzymem odpowiedzialnym za naprawę 7,8-dihydro-8-oksoguaniny, jednego z najczęstszych uszkodzeń oksydacyjnych mitochondrialnego DNA [53].
Badanie możliwości wpływania na aktywność hOGG1 poprzez zastosowanie CoQ10 może stanowić dla medycyny mitochondrialnej kolejny ważny kierunek działania w poszukiwaniu sposobów zapobiegania i zwalczania wielu chorób. Z drugiej strony, badania nad interakcją hOGG1 z białkami z rodziny TET (ten-eleven translocation), a tym samym nad wpływem na metylację DNA, pozostają wciąż we wstępnej fazie rozwoju [60].
W kontekście opisanych wyników badań nie dziwi fakt, że CoQ10 okazuje się być ważnym czynnikiem terapeutycznym w leczeniu chorób zwyrodnieniowych i związanych z wiekiem, takich jak choroby neurodegeneracyjne, mitochondriopatie, zwyrodnienie plamki żółtej związane z wiekiem i choroby układu krążenia [61 – 64]. W wielu chorobach klinicznych stwierdzano niski poziom endogennego CoQ10 w porównaniu z poziomem CoQ10 u osób zdrowych i wykazano, że znaczna część dysfunkcji mitochondrialnych idzie w parze z obniżonym poziomem CoQ10 w organizmie [3].
Dr. rer. nat. Daniel Schniertshauer, Prof. Dr. rer. nat. Jörg Bergemann, Hochschule Albstadt-Sigmaringen, Biomedical Sciences, Anton-Günther-Straße 51, 72488 Sigmaringen | Deutschland
Bibliografia:
[1] Krutmann J, Schroeder P. Role of mitochondria in photoaging of human skin: the defective powerhouse model. J Investig Dermatol Symp Proc. 2009 Aug;14(1):44-9. doi: 10.1038/jidsymp.2009.1. PMID: 19675552.
[2] Prinzinger R. Programmed ageing: the theory of maximal metabolic scope. How does the biological clock tick? EMBO Rep. 2005 Jul;6 Spec No(Suppl 1):S14-9. doi: 10.1038/sj.embor.7400425 . PMID: 15995655; PMCID: PMC1369273.
[3] Bentinger M, Tekle M, Dallner G. Coenzyme Q–biosynthesis and functions. Biochem Biophys Res Commun. 2010 May 21;396(1):74-9. doi: 10.1016/j.bbrc.2010.02.147. PMID: 20494114.
[4] Holt IJ, Harding AE, Morgan-Hughes JA. Deletions of muscle mitochondrial DNA in patients with mitochondrial myopathies. Nature. 1988 Feb 25;331(6158):717-9. doi: 10.1038/331717a0. PMID: 2830540.
[5] Holt IJ, Harding AE, Petty RK, Morgan-Hughes JA. A new mitochondrial disease associated with mitochondrial DNA heteroplasmy. Am J Hum Genet. 1990 Mar;46(3):428-33. PMID: 2137962; PMCID: PMC1683641.
[6] Macmillan C, Lach B, Shoubridge EA. Variable distribution of mutant mitochondrial DNAs (tRNA(Leu[3243])) in tissues of symptomatic relatives with MELAS: the role of mitotic segregation. Neurology. 1993 Aug;43(8):1586-90. doi: 10.1212/wnl.43.8.1586. PMID: 8351017.
[7] Koopman WJ, Willems PH, Smeitink JA. Monogenic mitochondrial disorders. N Engl J Med. 2012 Mar 22;366(12):1132-41. doi: 10.1056/NEJMra1012478. PMID: 22435372.
[8] Turunen M, Olsson J, Dallner G. Metabolism and function of coenzyme Q. Biochim Biophys Acta. 2004 Jan 28;1660(1-2):171-99. doi: 10.1016/j.bbamem.2003.11.012 . PMID: 14757233.
[9] Yang S, Lian G. ROS and diseases: role in metabolism and energy supply. Mol Cell Biochem. 2020 Apr;467(1-2):1-12. doi: 10.1007/s11010-019-03667-9 . Epub 2019 Dec 7. Erratum in: Mol Cell Biochem. 2020 Feb 17; PMID: 31813106; PMCID: PMC7089381.
[10] Krokan HE, Bjørås M. Base excision repair. Cold Spring Harb Perspect Biol. 2013 Apr 1;5(4):a012583. doi: 10.1101/cshperspect.a012583 . PMID: 23545420; PMCID: PMC3683898.
[11] Liou GY, Storz P. Reactive oxygen species in cancer. Free Radic Res. 2010 May;44(5):479-96. doi: 10.3109/10715761003667554 . PMID: 20370557; PMCID: PMC3880197.
[12] Birben E, Sahiner UM, Sackesen C, Erzurum S, Kalayci O. Oxidative stress and antioxidant defense. World Allergy Organ J. 2012 Jan;5(1):9-19. doi: 10.1097/WOX.0b013e3182439613 . Epub 2012 Jan 13. PMID: 23268465; PMCID: PMC3488923.
[13] Lambert AJ, Brand MD. Reactive oxygen species production by mitochondria. Methods Mol Biol. 2009;554:165-81. doi: 10.1007/978-1-59745-521-3_11. PMID: 19513674.
[14] Bottje WG. Oxidative metabolism and efficiency: the delicate balancing act of mitochondria. Poult Sci. 2019 Oct 1;98(10):4223-4230. doi: 10.3382/ps/pey405. PMID: 30371897.
[15] Hunte C, Zickermann V, Brandt U. Functional modules and structural basis of conformational coupling in mitochondrial complex I. Science. 2010 Jul 23;329(5990):448-51. doi: 10.1126/science.1191046 . Epub 2010 Jul 1. PMID: 20595580.
[16] Wirth CJ, Zichner L. Knippers R. Orthopädie und orthopädische Chirurgie: Stoffwechel- und Systemerkrankungen. Georg Thieme Verlag. 2003. ISBN 9783131269317.
[17] Furda AM, Marrangoni AM, Lokshin A, Van Houten B. Oxidants and not alkylating agents induce rapid mtDNA loss and mitochondrial dysfunction. DNA Repair (Amst). 2012 Aug 1;11(8):684-92. doi: 10.1016/j.dnarep.2012.06.002 . Epub 2012 Jul 4. PMID: 22766155; PMCID: PMC3878289.
[18] Yoshida T, Goto S, Kawakatsu M, Urata Y, Li TS. Mitochondrial dysfunction, a probable cause of persistent oxidative stress after exposure to ionizing radiation. Free Radic Res. 2012 Feb;46(2):147-53. doi: 10.3109/10715762.2011.645207 . Epub 2012 Jan 12. PMID: 22126415.
[19] Chinnery PF, Elliott HR, Hudson G, Samuels DC, Relton CL. Epigenetics, epidemiology and mitochondrial DNA diseases. Int J Epidemiol. 2012 Feb;41(1):177-87. doi: 10.1093/ije/dyr232 . Epub 2012 Jan 28. PMID: 22287136; PMCID: PMC3304530.
[20] DeBalsi KL, Hoff KE, Copeland WC. Role of the mitochondrial DNA replication machinery in mitochondrial DNA mutagenesis, aging and age-related diseases. Ageing Res Rev. 2017 Jan;33:89-104. doi: 10.1016/j.arr.2016.04.006 . Epub 2016 Apr 30. PMID: 27143693; PMCID: PMC5086445.
[21] Damian MS, Ellenberg D, Gildemeister R, Lauermann J, Simonis G, Sauter W, Georgi C. Coenzyme Q10 combined with mild hypothermia after cardiac arrest: a preliminary study. Circulation. 2004 Nov 9;110(19):3011-6. doi: 10.1161/01.CIR.0000146894.45533.C2. Epub 2004 Nov 1. PMID: 15520321.
[22] Harman D. The biologic clock: the mitochondria? J Am Geriatr Soc. 1972 Apr;20(4):145-7. doi: 10.1111/j.1532-5415.1972.tb00787.x. PMID: 5016631.
[23] Hazane F, Sauvaigo S, Douki T, Favier A, Beani JC. Age-dependent DNA repair and cell cycle distribution of human skin fibroblasts in response to UVA irradiation. J Photochem Photobiol B. 2006 Mar 1;82(3):214-23. doi: 10.1016/j.jphotobiol.2005.10.004. Epub 2006 Feb 7. PMID: 16460955.
[24] Prahl S, Kueper T, Biernoth T, Wöhrmann Y, Münster A, Fürstenau M, Schmidt M, Schulze C, Wittern KP, Wenck H, Muhr GM, Blatt T. Aging skin is functionally anaerobic: importance of coenzyme Q10 for anti aging skin care. Biofactors. 2008;32(1-4):245-55. doi: 10.1002/biof.5520320129. PMID: 19096122.
[25] Sauvaigo S, Bonnet-Duquennoy M, Odin F, Hazane-Puch F, Lachmann N, Bonté F, Kurfürst R, Favier A. DNA repair capacities of cutaneous fibroblasts: effect of sun exposure, age and smoking on response to an acute oxidative stress. Br J Dermatol. 2007 Jul;157(1):26-32. doi: 10.1111/j.1365-2133.2007.07890.x. PMID: 17578435.
[26] Wei YH, Wu SB, Ma YS, Lee HC. Respiratory function decline and DNA mutation in mitochondria, oxidative stress and altered gene expression during aging. Chang Gung Med J. 2009 Mar-Apr;32(2):113-32. PMID: 19403001.
[27] Lagouge M, Larsson NG. The role of mitochondrial DNA mutations and free radicals in disease and ageing. J Intern Med. 2013 Jun;273(6):529-43. doi: 10.1111/joim.12055 . Epub 2013 Mar 7. PMID: 23432181; PMCID: PMC3675642.
[28] Grivennikova VG, Vinogradov AD. Mitochondrial production of reactive oxygen species. Biochemistry (Mosc). 2013 Dec;78(13):1490-511. doi: 10.1134/S0006297913130087. PMID: 24490736.
[29] Richter C, Park JW, Ames BN. Normal oxidative damage to mitochondrial and nuclear DNA is extensive. Proc Natl Acad Sci U S A. 1988 Sep;85(17):6465-7. doi: 10.1073/pnas.85.17.6465. PMID: 3413108; PMCID: PMC281993.
[30] Yakes FM, Van Houten B. Mitochondrial DNA damage is more extensive and persists longer than nuclear DNA damage in human cells following oxidative stress. Proc Natl Acad Sci U S A. 1997 Jan 21;94(2):514-9. doi: 10.1073/pnas.94.2.514. PMID: 9012815; PMCID: PMC19544.
[31] Mutschler R. Regenerative Mitochondrien-Medizin – von der Forschung in die Praxis. Orthomol. Med. 2012 Mar;3:20-22
[32] Sies H. Oxidative stress: a concept in redox biology and medicine. Redox Biol. 2015;4:180-3. doi: 10.1016/j.redox.2015.01.002. Epub 2015 Jan 3. PMID: 25588755; PMCID: PMC4309861.
[33] Leonard SS, Xia C, Jiang BH, Stinefelt B, Klandorf H, Harris GK, Shi X. Resveratrol scavenges reactive oxygen species and effects radical-induced cellular responses. Biochem Biophys Res Commun. 2003 Oct 3;309(4):1017-26. doi: 10.1016/j.bbrc.2003.08.105. PMID: 13679076.
[34] Martinez J, Moreno JJ. Effect of resveratrol, a natural polyphenolic compound, on reactive oxygen species and prostaglandin production. Biochem Pharmacol. 2000 Apr 1;59(7):865-70. doi: 10.1016/s0006-2952(99)00380-9. PMID: 10718345.
[35] Partridge L, Fuentealba M, Kennedy BK. The quest to slow ageing through drug discovery. Nat Rev Drug Discov. 2020 Aug;19(8):513-532. doi: 10.1038/s41573-020-0067-7. Epub 2020 May 28. PMID: 32467649.
[36] Ren J, Zhang Y. Targeting Autophagy in Aging and Aging-Related Cardiovascular Diseases. Trends Pharmacol Sci. 2018 Dec;39(12):1064-1076. doi: 10.1016/j.tips.2018.10.005 . Epub 2018 Oct 26. PMID: 30458935; PMCID: PMC6251315.
[37] Wang J, Li S, Wang J, Wu F, Chen Y, Zhang H, Guo Y, Lin Y, Li L, Yu X, Liu T, Zhao Y. Spermidine alleviates cardiac aging by improving mitochondrial biogenesis and function. Aging (Albany NY). 2020 Jan 6;12(1):650-671. doi: 10.18632/aging.102647. Epub 2020 Jan 6. PMID: 31907336; PMCID: PMC6977682.
[38] Liu R, Li X, Ma H, Yang Q, Shang Q, Song L, Zheng Z, Zhang S, Pan Y, Huang P, Fang J, Li Y, Liu Z, Cao L, Feng C, Gong Z, Chen Y, Wang Y, Melino G, Shao C, Shi Y. Spermidine endows macrophages anti-inflammatory properties by inducing mitochondrial superoxide-dependent AMPK activation, Hif-1α upregulation and autophagy. Free Radic Biol Med. 2020 Dec;161:339-350. doi: 10.1016/j.freeradbiomed.2020.10.029 . Epub 2020 Oct 24. PMID: 33122005.
[39] Enzmann F. Das MitoMed-Konzept – mse Pharmazeutika GmbH. Abgerufen am 08. Januar 2022 von https://www.mse-pharma.de/mitomed-konzept/
[40] Pu Q, Guo XX, Hu JJ, Li AL, Li GG, Li XY. Nicotinamide mononucleotide increases cell viability and restores tight junctions in high-glucose-treated human corneal epithelial cells via the SIRT1/Nrf2/HO-1 pathway. Biomed Pharmacother. 2022 Feb 2;147:112659. doi: 10.1016/j.biopha.2022.112659. Epub ahead of print. PMID: 35123232.
[41] Liu X, Li D, Liu Z, Song Y, Zhang B, Zang Y, Zhang W, Niu Y, Shen C. Nicotinamide mononucleotide promotes pancreatic islet function through the SIRT1 pathway in mice after severe burns. Burns. 2022 Jan 20:S0305-4179(22)00015-8. doi: 10.1016/j.burns.2022.01.013. Epub ahead of print. PMID: 35123833.
[42] Crane FL. Biochemical functions of coenzyme Q10. J Am Coll Nutr. 2001 Dec;20(6):591-8. doi: 10.1080/07315724.2001.10719063. PMID: 11771674.
[43] Tomasetti M, Alleva R, Borghi B, Collins AR. In vivo supplementation with coenzyme Q10 enhances the recovery of human lymphocytes from oxidative DNA damage. FASEB J. 2001 Jun;15(8):1425-7. doi: 10.1096/fj.00-0694fje. PMID: 11387245.
[44] Evans M, Baisley J, Barss S, Guthrie N. A randomized, double-blind trial on the bioavailability of two CoQ10 formulations. J of Functional Foods. 2009:65-73. doi: 10.1016/j.jff.2008.09.010.
[45] Mitchell P. Protonmotive redox mechanism of the cytochrome b-c1 complex in the respiratory chain: protonmotive ubiquinone cycle. FEBS Lett. 1975 Aug 1;56(1):1-6. doi: 10.1016/0014-5793(75)80098-6. PMID: 239860.
[46] Lenaz G, Genova ML. Mobility and function of coenzyme Q (ubiquinone) in the mitochondrial respiratory chain. Biochim Biophys Acta. 2009 Jun;1787(6):563-73. doi: 10.1016/j.bbabio.2009.02.019. Epub 2009 Mar 4. PMID: 19268424.
[47] Estornell E, Fato R, Castelluccio C, Cavazzoni M, Parenti Castelli G, Lenaz G. Saturation kinetics of coenzyme Q in NADH and succinate oxidation in beef heart mitochondria. FEBS Lett. 1992 Oct 19;311(2):107-9. doi: 10.1016/0014-5793(92)81378-y. PMID: 1327877.
[48] Littarru GP, Tiano L. Bioenergetic and antioxidant properties of coenzyme Q10: recent developments. Mol Biotechnol. 2007 Sep;37(1):31-7. doi: 10.1007/s12033-007-0052-y. PMID: 17914161.
[49] Schniertshauer D, Müller S, Mayr T, Sonntag T, Gebhard D, Bergemann J. Accelerated Regeneration of ATP Level after Irradiation in Human Skin Fibroblasts by Coenzyme Q10. Photochem Photobiol. 2016 May;92(3):488-94. doi: 10.1111/php.12583. Epub 2016 Apr 18. PMID: 26946184.
[50] Schniertshauer D, Gebhard D, Bergemann J. Age-Dependent Loss of Mitochondrial Function in Epithelial Tissue Can Be Reversed by Coenzyme Q10. J Aging Res. 2018 Sep 5;2018:6354680. doi: 10.1155/2018/6354680. PMID: 30254763; PMCID: PMC6145312.
[51] Bentinger M, Brismar K, Dallner G. The antioxidant role of coenzyme Q. Mitochondrion. 2007 Jun;7 Suppl:S41-50. doi: 10.1016/j.mito.2007.02.006. Epub 2007 Mar 16. PMID: 17482888.
[52] Nordman T, Xia L, Björkhem-Bergman L, Damdimopoulos A, Nalvarte I, Arnér ES, Spyrou G, Eriksson LC, Björnstedt M, Olsson JM. Regeneration of the antioxidant ubiquinol by lipoamide dehydrogenase, thioredoxin reductase and glutathione reductase. Biofactors. 2003;18(1-4):45-50. doi: 10.1002/biof.5520180206. PMID: 14695919.
[53] Schniertshauer D, Gebhard D, van Beek H, Nöth V, Schon J, Bergemann J. The activity of the DNA repair enzyme hOGG1 can be directly modulated by ubiquinol. DNA Repair (Amst). 2020 Mar;87:102784. doi: 10.1016/j.dnarep.2019.102784. Epub 2020 Jan 3. PMID: 31923624.
[54] Su YH, Lee YL, Chen SF, Lee YP, Hsieh YH, Tsai JH, Hsu JL, Tian WT, Huang W. Essential role of β-human 8-oxoguanine DNA glycosylase 1 in mitochondrial oxidative DNA repair. Environ Mol Mutagen. 2013 Jan;54(1):54-64. doi: 10.1002/em.21742. Epub 2012 Oct 11. PMID: 23055259.
[55] Edeas M. Strategies to target mitochondria and oxidative stress by antioxidants: key points and perspectives. Pharm Res. 2011 Nov;28(11):2771-9. doi: 10.1007/s11095-011-0587-2. Epub 2011 Sep 15. PMID: 21918914.
[56] Perumal SS, Shanthi P, Sachdanandam P. Augmented efficacy of tamoxifen in rat breast tumorigenesis when gavaged along with riboflavin, niacin, and CoQ10: effects on lipid peroxidation and antioxidants in mitochondria. Chem Biol Interact. 2005 Feb 28;152(1):49-58. doi: 10.1016/j.cbi.2005.01.007. PMID: 15766922.
[57] Echtay KS, Winkler E, Klingenberg M. Coenzyme Q is an obligatory cofactor for uncoupling protein function. Nature. 2000 Nov 30;408(6812):609-13. doi: 10.1038/35046114. PMID: 11117751.
[58] Echtay KS, Winkler E, Frischmuth K, Klingenberg M. Uncoupling proteins 2 and 3 are highly active H(+) transporters and highly nucleotide sensitive when activated by coenzyme Q (ubiquinone). Proc Natl Acad Sci U S A. 2001 Feb 13;98(4):1416-21. doi: 10.1073/pnas.98.4.1416. PMID: 11171965; PMCID: PMC29271.
[59] Nedergaard J, Ricquier D, Kozak LP. Uncoupling proteins: current status and therapeutic prospects. EMBO Rep. 2005 Oct;6(10):917-21. doi: 10.1038/sj.embor.7400532. PMID: 16179945; PMCID: PMC1369193.
[60] Zhou X, Zhuang Z, Wang W, He L, Wu H, Cao Y, Pan F, Zhao J, Hu Z, Sekhar C, Guo Z. OGG1 is essential in oxidative stress induced DNA demethylation. Cell Signal. 2016 Sep;28(9):1163-71. doi: 10.1016/j.cellsig.2016.05.021. Epub 2016 May 29. PMID: 27251462.
[61] Beal MF. Mitochondrial dysfunction and oxidative damage in Alzheimer’s and Parkinson’s diseases and coenzyme Q10 as a potential treatment. J Bioenerg Biomembr. 2004 Aug;36(4):381-6. doi: 10.1023/B:JOBB.0000041772.74810.92. PMID: 15377876.
[62] Blasi MA, Bovina C, Carella G, Genova ML, Jansen AM, Lenaz G, Brancato R. Does coenzyme Q10 play a role in opposing oxidative stress in patients with age-related macular degeneration? Ophthalmologica. 2001 Jan-Feb;215(1):51-4. doi: 10.1159/000050826. PMID: 11125270.
[63] Chen RS, Huang CC, Chu NS. Coenzyme Q10 treatment in mitochondrial encephalomyopathies. Short-term double-blind, crossover study. Eur Neurol. 1997;37(4):212-8. doi: 10.1159/000117445. PMID: 9208260.
[64] Damian MS, Ellenberg D, Gildemeister R, Lauermann J, Simonis G, Sauter W, Georgi C. Coenzyme Q10 combined with mild hypothermia after cardiac arrest: a preliminary study. Circulation. 2004 Nov 9;110(19):3011-6. doi: 10.1161/01.CIR.0000146894.45533.C2. Epub 2004 Nov 1. PMID: 15520321.