Zdrowy metabolizm oraz zdrowe mitochondria to pojęcia synonimiczne [2]
Wszystko zaczęło się kilka tysięcy milionów lat temu – od bakterii, a dokładniej cyjanobakterii, które przetrwały do dzisiaj i które mylnie zalicza się niekiedy do rodziny alg [1].
Następnie przez tysiące i setki tysięcy lat na drodze ewolucji doszło do rozwinięcia się komórek, co umożliwiło z kolei powstanie skomplikowanych organizmów żywych, w tym człowieka. Dzisiaj nasz organizm to nic innego jak dom dla miliardów różnorodnych bakterii, których obecność wywiera istotny wpływ na procesy metaboliczne oraz czynności życiowe. Uczeni już dawno zaobserwowali, iż metabolity na przykład bakterii jelitowych współdecydują o naszym zdrowiu a także długości życia, jednak nie mieli do końca pewności co do kryjącego się za tym mechanizmu. Jak się wydaje, kluczem do rozwiązania zagadki tak potężnego wpływu bakterii na organizm człowieka są dobrze znane nam komórkowe elektrownie czyli mitochondria.
Między nami bakteriami i mitochondriami
Mitochondria odpowiadają za przebieg licznych, kluczowych dla naszego życia procesów, a wśród nich oksydacji kwasów tłuszczowych oraz fosforylacji oksydacyjnej i produkcji energii w formie cząstek ATP. Co ciekawe, czynności te pełnią jednocześnie funkcję przekaźnikową i współregulują aktywność jądra komórkowego. Aktywność mitochondriów moduluje ekspresję DNA jądra oraz działanie poszczególnych czynników transkrypcji – innymi słowy to, jak się „wiedzie“ naszym mitochondriom bezpośrednio wpływa na pracę i procesy genetyczne w obrębie naszych komórek. Jednocześnie ponieważ badania naukowe potwierdziły, iż mitochondria wywodzą się od bakterii (a dokładniej mówiąc bakterii spokrewnionych ze szczepem riketsji, łac. Rickettsia) rola metabolicznego „tłumacza”, którą mogłyby spełniać mitochondria w stosunku do komórek i zasiedlających nasz organizm bakterii nasuwa się sama. Jak się wydaje harmonijna symbioza mitochondriów, komórek oraz mikroflory (jelitowej) wywiera znaczny wpływ na przebieg procesów fizjologicznych w organizmie gospodarza, a także jego stan zdrowia i długość życia [5].
Mitochondria oraz bakterie jelitowe mają ze sobą wiele wspólnego do dzisiaj – na przykład możliwość metabolizowania substancji odżywczych. Nasza flora jelitowa jest w stanie nie tylko wytwarzać niektóre witaminy (m. in. witaminy B1, B2, kwas pantotenowy, biotynę, witaminę B12 oraz witaminę K) [4], lecz syntetyzować również inne związki chemiczne. W ostatnich latach pojawiło się coraz więcej dowodów na to, że produkowane przez mikrobiom trzy kluczowe metabolity:
- Krótkołańcuchowe kwasy tłuszczowe z kwasem masłowym na czele
- Urolityny (w szczególności urolityna A)
- Kwas mlekowy,
wpływają na funkcjonowanie oraz biogenezę samych mitochondriów, na przykład poprzez aktywację specjalnego enzymu kinazy AMP. Jednocześnie zarówno kwas masłowy jak również urolityna A sprzyjają liczebności oraz różnorodności samego mikrobiomu.
Czym jest urolityna A?
Urolityna A to naturalny produkt bakteryjnego rozkładu kwasu elagowego – związku chemicznego z rodziny fenoli, którego największe ilości znajdziemy w orzechach włoskich, orzechach pekan, żurawinie, truskawkach oraz malinach i jagodach granatu [7]. Zdolność produkcji urolityny A z kwasu elagowego wykazują przede wszystkim bakterie kwasu mlekowego oraz bifidobakterie. Przypuszczalnie związki kwasu elagowego mogą mieć działanie przeciwnowotworowe a także przyspieszać regenerację powysiłkowych mikrouszkodzeń mięśni. Jednocześnie sama urolityna A stymuluje mitofagię (celową eliminację uszkodzonych mitochondriów lub ich fragmentów na drodze autofagii, która służy jednocześnie przystosowaniu tkanek do zmian zapotrzebowania energetycznego) oraz wydaje się sprzyjać wydłużaniu życia [6].
„Porozmawiaj z nią”
Ze względu na podobną rolę odgrywaną w życiu człowieka – współudział w procesach metabolicznych oraz odpornościowych a także z uwagi na wspólną przeszłość, hipoteza, iż mitochondria oraz zamieszkujące nasz organizm bakterie pozostają ze sobą w ścisłym kontakcie i mogą się ze sobą komunikować, wydaje się być jak najbardziej naturalna. Uczeni, którzy zainteresowali się tym tematem, poszli nawet o krok dalej, spekulując, iż wpływ, jaki jest wywierany przez mikrobiom na nasz organizm, ma wiele wspólnego z wykazywaną przez niego zdolnością regulowania procesów, które przebiegają na poziomie mitochondrialnym. Z kolei zmiany w zakresie diety gospodarza, jego stylu życia, ewentualna antybiotykoterapia i inne przyjmowane leki mogą w drastyczny sposób modyfikować zarówno skład jak również same czynności bakterii jelitowych. Tymczasem jak wskazują badania: kompozycja, liczebność oraz namnażanie mikrobiomu to istotne markery naszych procesów starzenia [5].
Poniżej kilka konkretnych przykładów takiego cross-talku czyli „chemicznych pogaduszek” między bakteriami a komórkami/mitochondriami:
- Bakteryjne metabolity takie jak betaina, metionina oraz homocysteina inicjują szlaki sygnałowe, aktywujące jądrowy receptor 5A, a poprzez to – regulują procesy fizji – fuzji w mitochondriach komórek jelitowych i jak się wydaje, regulują dynamikę magazynowania tłuszczu w organizmie gospodarza [5]
- Produkowany przez bakterie kwas colanic acid to wielocukier, główny składnik biofilmu chroniącego komórki bakterii E.Coli. Po przedostaniu się do cytoplazmy komórek gospodarza colanic acid pozytywnie wpływa na biogenezę mitochondriów oraz chroni nas przed takimi kojarzonymi z procesami starzenia i patologicznymi procesami jak akumulacja toksycznego beta-amyloidu, a tym samym wydłuża nasze życie [8]
- Kwas masłowy a mitochondria komórek jelitowych. Kwas masłowy to główne źródło energii dla kolonocytów czyli komórek nabłonka jelitowego. Substratem do produkcji kwasu masłowego są niestrawione węglowodany. Badania wśród pacjentów z chorobą Crohna-Leśniowskiego wykazały u nich znaczący spadek liczebności bakterii syntetyzujących maślan oraz jednoczesny spadek ilości białek mitochondrialnych. Na tej podstawie uczeni wysnuli przypuszczenie, iż kwas masłowy spełnia rolę sygnałową wobec mitochondrialnego genomu gospodarza. Hipotezę tę popiera kolejna obserwacja: kwas masłowy sprzyja zwiększaniu ekspresji genów, które sprzyjają odtruwaniu organizmu z toksycznego siarkowodoru: H2S. Tymczasem nadmiar siarkowodoru w organizmie jest bardzo często stwierdzany właśnie wśród pacjentów z chorobą Crohna-Leśniowskiego, której towarzyszą między innymi zaburzenia mikroflory jelitowej. Jednocześnie uszkodzone mitochondria produkują znacznie więcej wolnych rodników tlenowych (ROS), co z kolei przyczynia się do uszkodzeń ściany jelit i sprzyja reakcjom autoimmunologicznym, które, jak przekonamy się w kolejnym punkcie, z dużym prawdopodobieństwem dodatkowo hamują mitochondrialną produkcję energii [2]
- Opublikowane w 2004 roku studium przypadku dziecka, które cierpiało z powodu epilepsji, osłabienia pracy mięśni oraz problemów z oddychaniem i choroby Crohna-Leśniowskiego sugeruje bezpośredni związek pomiędzy zaburzeniami funkcjonowania mitochondriów (blokady w obrębie III i IV łańcucha oddechowego) a stanem jej jelit. Autorzy artykułu zadali sobie przy tym pytanie, czy za blokadę pracy mitochondriów mogły odpowiadać krążące w organizmie dziewczynki cytokiny stanu zapalnego. Za pozytywną odpowiedzią na to pytanie przemawiał fakt, iż terapia przeciwciałami TNF alfa pomogła wyeliminować objawy choroby Crohna-Leśniowskiego oraz to, że TNF alfa faktycznie może mediować zakłócenia w obrębie mitochondrialnego łańcucha oddechowego [9]
- Kwas masłowy oraz mitochondria komórek mięśniowych. Mięśnie stanowią największą część naszego wolumenu tkanek, wykazując jednocześnie wysoką gęstość mitochondriów i cechując się dużą aktywnością metaboliczną. Ponieważ nasz styl życia (w tym aktywność fizyczna) oraz dieta wywierają pozytywny wpływ zarówno na mięśnie (z samymi mitochondriami włącznie) jak również na mikrobiom jelitowy, uczeni wysunęli hipotezę, że oba systemy muszą być ze sobą biologicznie wzajemnie powiązane. Jak się wydaje, nasza sprawność fizyczna jest pozytywnie skorelowana z poziomem kwasu masłowego jak również z ilością bakterii szczepów Clostridium spp. oraz bakterii kwasu mlekowego w jelitach. Oprócz tego zarówno kwas masłowy jak też urolityna A – czyli metabolity bakterii jelitowych pozytywnie wpływają na czynności oddechowe komórek mięśniowych, sprzyjając prawidłowej pracy mitochondriów tych komórek. Ponadto bardzo prawdopodobne, iż obserwowanej wraz z wiekiem stopniowej utracie masy mięśniowej (sarkopenii) nieprzypadkowo towarzyszy również pogłębiająca się dyzbioza jelitowa [3]. Wszystkie przytoczone zjawiska przemawiają za tym, iż produkty metabolizmu bakterii w znaczący sposób wpływają na pracę samych mitochondriów i poprzez to – również komórek, potwierdzając tym samym komunikację, jaka zachodzi pomiędzy tymi dwoma światami
Wzajemna komunikacja pomiędzy mitochondriami a bakteriami [5]
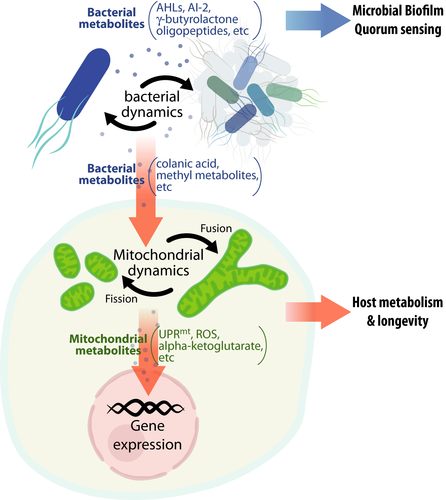
Komentarz do obrazka: Zgodnie z najnowszymi odkryciami naukowymi, mitochondrialne procesy fuzji (łączenia się) oraz fizji (podziałów) mogą podlegać regulacji poprzez chemiczne substancje sygnałowe, których źródłem są bakterie symbiotyczne. Do substancji tych należą między innymi kwas colanic acid oraz metabolity zawierające grupy metylowe. Taka komunikacja crosstalk wydaje się odgrywać istotną rolę dla zachowania zdrowia gospodarza, ponieważ mechanizmy związane z fuzją i fizją mitochondriów przyczyniają się do zapewniania możliwie jak największej wydajności produkcji ATP. Jak się wydaje, procesy fuzji wspierają efektywność energetyczną mitochondriów, podczas gdy prowadzący do nasilenia fizji nadmiar makroskładników odżywczych w diecie ogranicza prawidłowy przebieg fosforylacji oksydacyjnej i aktywności syntaz ATP. W ten sposób zarówno dieta nadmiernie bogata w węglowodany jak również w tłuszcz zamiast dodawać nam dodatkowej porcji energii, jedynie spowalnia nasz metabolizm i prowadzi do uszkodzeń na poziomie mitochondrialnym.
„Wielkie żarcie” czyli komunikacja komórek żernych z mitochondriami
W tym miejscu wspomnijmy jeszcze pokrótce o chemicznej komunikacji bakterii jelitowych z komórkami odpornościowymi a docelowo – mitochondriami.
Jak już wiesz, mikrobiom jelitowy współdecyduje o funkcjonowaniu naszego układu odpornościowego. W momencie przesunięcia równowagi mikroflory jelit w stronę patogennych bakterii anaerobowych (dysbiozy) dochodzi do uszkodzenia błony śluzowej jelit oraz wzrostu produkcji tlenku azotu NO, który z kolei aktywuje produkcję różnych chemokin, cytokin oraz stymuluje makrofagi M1. Makrofagi M1 preferują glukozę jako źródło energii i rozprzęgają mitochondrialne reakcje OXPHOS, co ma na celu zwiększenie produkcji wolnych rodników tlenowych (ROS) a także jeszcze większych ilości NO – obie substancje stanowią silną broń przeciwko patogenom. Jednak proces ten ma swoją cenę: zaburza mitochondrialną produkcję energii i w dłuższym okresie prowadzi do insulinooporności, otyłości oraz zespołu metabolicznego, a w konsekwencji – zaburzeń produkcji energii w organizmie, niedoboru ATP i wtórnej mitochondriopatii [10].
Co to oznacza w praktyce?
W świetle powyższych rozważań wydaje się, iż mitochondria jako producenci energii w organizmie, są w stanie dostarczać nam wystarczających ilości ATP jedynie w warunkach prawidłowego składu mikrobiomu jelitowego oraz braku przewlekłych stanów zapalnych w organizmie.
Ścisła relacja jaka łączy mitochondria, bakterie oraz układ odpornościowy każe nam myśleć o jelitach i funkcjach immunologicznych jako nieodłącznym elemencie terapii mitochondrialnej.
Zgodnie z wynikami badań, szczepy bakterii Bifidus oraz Lactobacillus plantaram są w stanie modulować negatywne (prozapalne) efekty diet wysokotłuszczowych oraz łagodzić reakcje odpornościowe wynikające z chorób zapalnych. Jednocześnie bakterie te wykazują zdolność produkowania kwasu foliowego i innych witamin (z witaminą B12 i K na czele) oraz krótkołańcuchowych kwasów tłuszczowych, w tym kwasu octowego, który może posłużyć glukoneogenezie. Przyjazne bakterie jelitowe przekształcają karnitynę oraz cholinę do trimetyloaminy, przez co regulują biodostępność choliny w organizmie a bezpośrednio – akumulację trójglicerydów w wątrobie. Mikrobiom jelitowy wspomaga też absorpcję takich kofaktorów mitochondrialnych enzymów jak żelazo czy magnez [10].
Prawidłowy skład flory jelitowej przyczynia się zatem do normalnego funkcjonowania mitochondriów, dlatego jeżeli chcesz zadbać o swój status energetyczny i dobre samopoczucie na co dzień:
- Zadbaj o prawidłowy skład flory jelitowej – po każdej antybiotykoterapii przeprowadzając przynajmniej trzymiesięczną kurację wysokiej jakości probiotykiem wieloszczepowy
- Włącz do diety domowe kiszonki (pasteryzacja zabija żywe bakterie) oraz domowy jogurt lub kefir (jako startera możesz użyć kapsułek z probiotykiem lub grzybków kefirowych)
- Zadbaj o wystarczającą ilość błonnika w diecie (prebiotyki) – pomyśl o inulinie, skrobi opornej czy oligofruktozie.
- W przypadku podejrzenia dysbiozy lub grzybicy (Candida), rozważ odpowiednią terapię
- W celu uszczelnienia jelit i zadbania o wszystkie błony komórkowe włącz do diety produkty bogate w kwasy tłuszczowe omega-3 i/lub rozważ odpowiednią suplementację wysokooczyszczonym preparatem na bazie oleju rybiego, kryla lub alg morskich. Całość uzupełnij pochodnymi choliny: CDP-choliną i fosfatydylocholiną dla szybszej i efektywniejszej regeneracji ścian komórkowych.
- Ogranicz spożycie prozapalnych substancji, takich jak kwasy tłuszczowe omega-6, a w razie konieczności również glutenu, kazeiny i albuminy z mleka. U niektórych pacjentów doskonale sprawdzi się również ograniczenie spożycia produktów bogatych w histaminę i tzw. liberatorów histaminy.
- Eliminacja wszelkich ognisk przewlekłych stanów zapalnych odciąża układ odpornościowy a tym samym umożliwia aktywację optymalnych szlaków produkcji energii. Pomyśl przede wszystkim o niewyleczonych infekcjach zębów lub dziąseł, infekcjach grzybiczych lub pasożytniczych, H. pylori w żołądku, infekcjach wirusowych – np. opryszczka.
**
Podsumowując, zgodnie z zasadą tzw. brzytwy Ockhama, (która mówi nam, iż zawsze należy szukać najprostszego wyjaśnienia danego zjawiska i jednocześnie takiego, które wymaga jak najmniejszej liczby założeń) wiele wskazuje na to, iż bakterie faktycznie porozumiewają się z mitochondriami i to w sposób bezpośredni – wysyłając im sygnały w postaci różnych bakteryjnych metabolitów.
Z całą pewnością zagadnienie „pogaduszek”, jakie prowadzą ze sobą mitochondria/komórki oraz nasze bakterie wymaga dalszych celowych badań, które mogłyby skupić się na próbie identyfikacji konkretnych substancji przekaźnikowych, mechanizmów transportowych poprzez błony komórkowe czy też receptorów takich substancji, które są zlokalizowane w obrębie zewnętrznej błony mitochondrialnej.
Autor: Sylwia Grodzicka
Bibliografia:
1. http://www.earlyearthcentral.com/early_life_page.html
2. https://www.nature.com/articles/ncomms13419/
3. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5425687/
4. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3144392/
5. https://febs.onlinelibrary.wiley.com/doi/full/10.1111/febs.14692#febs14692-bib-0012
6. https://pubmed.ncbi.nlm.nih.gov/27400265/
7. https://pubmed.ncbi.nlm.nih.gov/26051169/
8. https://pubmed.ncbi.nlm.nih.gov/28622510/
9. https://journals.lww.com/jpgn/Fulltext/2004/05000/Mitochondrial_Dysfunction_in_a_Patient_with_Crohn.14.aspx
10. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6304917/