Uczenie się od natury
stanowi podstawową zasadę biomedycyny. Również w dziedzinie zdrowego starzenia się przyroda dostarcza nam imponujących wzorców do naśladowania. Jednym z dość niezwykłych, przynajmniej na pierwszy rzut oka, przykładów długowieczności, jest golec piaskowy. Może nie najpiękniejszy, za to obdarzony przez matkę naturę ponadprzeciętną autofagią i równie niezwykłą długością życia.
Heterocephalus glaber to niewielki gryzoń występujący we wschodniej Afryce, gdzie zamieszkuje długie, grzebane przez siebie tunele. Nie grzeszy urodą, za to posiada zdolności, których niejeden z nas by mu pozazdrościł. Przy całkiem niezłej kondycji, osiąga imponujący wiek i niemal nigdy nie choruje na raka. Golec piaskowy może żyć nawet do 10 razy dłużej niż spokrewniona z nim mysz i nierzadko dożywa w dobrym zdrowiu 30 lat, a nawet więcej.
Gdyby przyrównać jego wiek do wieku ludzi, dożywalibyśmy wieku biblijnego Matuzalema. Długowieczność golca piaskowego rodzi pytanie o sekrety komórkowe tego rodzaju „cudownych zwierząt” i ich ewentualne wykorzystanie w leczeniu ludzi. U golców wykryto szereg czynników, które prowadzą do lepszego oczyszczania i regeneracji komórek. Podobnych obserwacji dokonano też u innych długowiecznych zwierząt. Fakt ten podkreśla z jednej strony znaczenie w badaniach biomedycznych organizmów modelowych, z drugiej zaś szczególną rolę procesów eliminowania zużytych czynników i regeneracji dla utrzymania zdrowia ssaków.
Autofagia to kluczowy, wielofunkcyjny system kontroli jakości i recyklingu w naszych komórkach
Utrzymanie równowagi pomiędzy akumulowaniem składników cytoplazmatycznych w komórce i ich rozkładem (recyklingiem) ma fundamentalne znaczenie dla utrzymania zdrowia naszego organizmu. Kiedy równowaga ta zostaje zaburzona, np. w efekcie nieodpowiedniego recyklingu, nadmierne nagromadzenie odpadów komórkowych może prowadzić do zaburzenia funkcji komórek i poważnych chorób. Autofagia odgrywa również rolę w innych kluczowych sieciach regulacyjnych. Przykładowo, odpowiednio szybkie usuwanie uszkodzonych mitochondriów w odpowiedzi na stres oksydacyjny zapobiega śmierci komórek (apoptozie) wyzwalanej przez cytochrom C oraz zapewnia wystarczającą produkcję ATP.
Nasze komórki nieprzerwanie generują niezliczone ilości zużytych i uszkodzonych składników cytoplazmy. Uszkodzone składniki budulcowe komórek, takie jak białka lub organelle, mogą mieć bardzo szkodliwy wpływ na fizjologię komórki, a także uszkadzać jej materiał genetyczny. Aby temu zapobiec, nasze komórki rozwinęły wysoce wydajne wewnątrzkomórkowe mechanizmy kontroli jakości i recyklingu. Centralną rolę odgrywa w tych mechanizmach autofagia, która współpracuje z innymi układami, takimi jak np. układ ubikwityna-proteasom (UPS). Układ ten służy w pierwszym rzędzie do eliminowania krótko istniejących i prawidłowo pofałdowanych białek, podczas gdy autofagocytoza odpowiada za degradację składników cytoplazmatycznych, uszkodzonych organelli i długotrwale funkcjonujących, silnie zagregowanych białek.5-7
Autofagia jest podstawowym, wielofunkcyjnym mechanizmem sprawującym kontrolę nad jakością i recyklingiem naszych komórek. Termin ten wywodzi się ze starożytnej greki i oznacza tyle, co „samozjadanie”. Procesem pokrewnym jest fagocytoza, dzięki której komórka wchłania substancje pochodzące z zewnątrz, aby następnie wykorzystać je na swoje potrzeby. Zjawisko autofagii opisano po raz pierwszy w latach 60-tych XX. wieku. Temat ten szybko podchwyciły różne zespoły badawcze, publikując szereg ważnych artykułów. Szczególna rola przypadła w tym względzie japońskiemu badaczowi Yoshinori Ohsumi. W latach 90-tych, dzięki badaniom na modelowym organizmie drożdży, Ohsumi wykrył 15 genów znacząco zaangażowanych w proces autofagii. Co więcej, był w stanie opisać, w jaki sposób autofagia kontrolowana jest przez złożony system sygnalizacyjny. Prace te podkreślają istotne znaczenie procesu autofagii dla ludzkiego zdrowia, za co ich autor otrzymał w 2016 roku Nagrodę Nobla w dziedzinie medycyny.5-6
Dziś wiemy, że autofagia przejawia się w różnych wariantach, pełniąc rozmaite funkcje, dlatego słusznie określa się ją mianem wielofunkcyjnej. Poniżej przytoczono kilka przykładów tej różnorodności, chociaż należy zauważyć, że także same procesy mogą być opisywane w rozmaity sposób:
- Najbardziej znaną postacią autofagii jest makroautofagia. Dlatego bywa często synonimicznie zwana autofagią. Komórka formuje z podwójnej błony lipidowo-białkowej pęcherzyk zwany autofagosomem, którym otacza materiał komórkowy przeznaczony do utylizacji. Cytoszkielet komórki transportuje następnie autofagosom w miejsce, w którym autofagosom może się połączyć z lizosomem. Zawarte w tym ostatnim hydrolazy rozkładają uszkodzony materiał komórkowy na czynniki proste, które mogą zostać powtórnie wykorzystane (recykling).
- Mikroautofagia występuje głównie w komórkach drożdży. W przeciwieństwie do makroautofagii, pobranie z cytoplazmy materiału przeznaczonego do utylizacji następuje bezpośrednio, poprzez wpuklenie błony lizosomalnej do wnętrza lizosomu.
- Autofagia zależna od białek opiekuńczych (czaperonów) odgrywa ważną rolę w komórkach ssaków. Czaperony rozpoznają uszkodzone białka, transportują je do lizosomów, gdzie białka te wiążą się z receptorami na błonie lizosomu. Mechanizm ten bywa też określany mianem autofagii wyspecjalizowanej, ponieważ czaperony wychwytują białka o ściśle określonych sekwencjach aminokwasów.
- Autofagia nieselektywna: pierwotnie zakładano, że autofagia nie jest procesem wybiórczym. Zgodnie z ówczesnym założeniem, fragment cytozolu i zawarte w nim składniki komórkowe byłyby losowo zamykane w autofagosomach, których zawartość podlegałaby następnie degradacji. Obecnie przyjmuje się, że duża część autofagii ma charakter selektywny, czyli zależny od receptorów.
- Agrefagia jest procesem selektywnym służącym do eliminowania agregatów białkowych na zasadzie makroautofagii. Zagregowane białka wiążą się z ubikwityną, a powstałe agregaty są rozpoznawane przez receptory wiążące ubikwitynę.8
- Mitofagia jest formą autofagii, której celem jest eliminacja uszkodzonych mitochondriów. Komórka rozpoznaje uszkodzone mitochondria po zmianach w obrębie błon mitochondrialnych. Wybrane mitochondrium zostaje otoczone strukturą błonową, powstaje mitofagosom, który następnie ulega fuzji z lizosomem.
- Fagia retikulum endoplazmatycznego (RE): autofagia może też służyć do usuwania innych organelli, jak na przykład retikulum endoplazmatycznego. Ten rodzaj selektywnej autofagii eliminuje w porę uszkodzone RE, chroniąc komórkę przed stresem związanym z nagromadzeniem uszkodzeń retikulum.9
- Kolejną odmianą selektywnej autofagii jest ksenofagia stanowiąca strategię, za pomocą której komórki bronią się przed namnażaniem inwazyjnych patogenów. Celem ksenofagii jest wyłapywanie obcych białek lub patogenów, które zaatakowały komórkę, po czym eliminowanie ich poprzez rozkład w lizosomach. Proces ten wspiera również odpowiedź immunologiczną, a dokładniej prezentację antygenu za pośrednictwem MHCI i MHCII. W kontekście ksenofagii istotną rolę odgrywają też inne procesy, jak degradacja białek wirusowych z pomocą proteasomu lub immunoproteasomu.
- Fragmentaryczna mikroautofagia jądra (PMN) jest kolejnym procesem, który ma jedynie pokazać, że poznane dotąd odmiany autofagii będą się cieszyć w przyszłości jeszcze większym zainteresowaniem.5-7
Autofagia to bardzo złożony, precyzyjnie regulowany proces
Autofagia jest procesem podlegającym precyzyjnej regulacji przez szereg białek związanych z autofagią (ATG). W proces regulacji zaangażowanych jest w naszych komórkach ponad 30 genów. Procesem autofagii steruje szereg różnych czynników promujących wychwyt składników odżywczych, takich jak kinaza mTOR lub kinaza białkowa aktywowana przez AMP (AMPK). Z grubsza rzecz ujmując, proces autofagii można podzielić na następujące fazy (patrz Rys. 1):
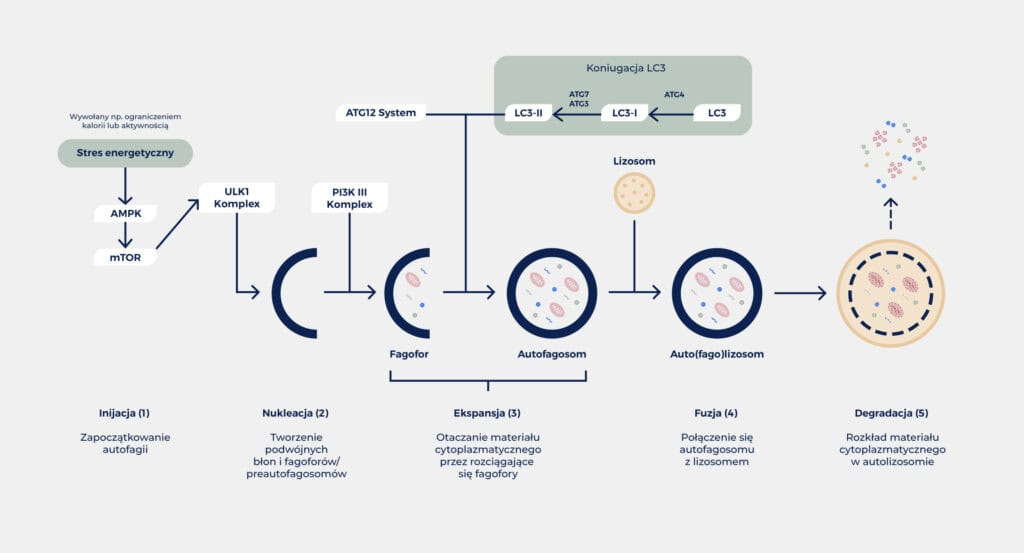
- Zainicjowanie autofagii
- Tworzenie podwójnych błon i fagoforów / preautofagosomów
- Ekspansja fagoforów i otaczanie materiału cytoplazmatycznego
- Fuzja autofagosomu z lizosomem
- Rozkład materiału zawartego w autolizosomie10,11
Po zainicjowaniu autofagii następuje gromadzenie określonych białek ATG, w szczególności kompleksu ULK1, w konkretnym miejscu komórki. Powstaje tam zaczątek błony, z którego następnie formowany jest fagofor w kształcie miseczki. Tak powstała podwójna błona lipidowo-białkowa jest następnie rozbudowywana do momentu, w którym w pełni otoczy uszkodzony materiał cytoplazmatyczny przeznaczony do utylizacji. Mogą nim być np. uszkodzone białka, ale też całe organelle, które komórka takim sposobem rozkłada i udostępnia do ponownego wykorzystania (recykling). Kolejną ważną grupą białek są białka z rodziny LC3 (ang. łańcuchy lekkie białka związanego z mikrotubulami). Po przeorganizowaniu w procesie proteolizy oraz związaniu z błonami autofagosomu białka te odgrywają kluczową rolę w rozpoznawaniu materiału cytoplazmatycznego poprzez interakcję z receptorami autofagii. Białko LC3 w postaci związanego z błoną, lipidowanego kompleksu LC3BII tworzy strukturę charakterystyczną dla błon autofagosomów. Jest ona często wykorzystywana jako marker do wykrywania dojrzałych autofagosomów, co pozwala badaczom monitorować poziom autofagii. W pełni uformowane autofagosomy łączą się następnie z lizosomami, tworząc tak zwane autolizosomy, we wnętrzu których następuje rozkład materiału cytoplazmatycznego pod wpływem hydrolitycznego środowiska autolizosomu. Komórka odzyskuje w ten sposób podstawowy materiał budulcowy, który może ponownie wykorzystać do syntezy nowych makrocząsteczek.10,11
Jak można mierzyć intensywność autofagii?
Powstaje pytanie, czy autofagię da się zmierzyć. W przeciwieństwie do innych parametrów fizjologicznych, takich jak ciśnienie krwi, mierzenie autofagii jest bardziej skomplikowane. W niektórych testach laboratoryjnych stosuje się barwienie pęcherzyków autofagicznych, co pozwala określić ich ilość. Metoda ta świetnie sprawdza się w zastosowaniach do pewnych typów komórek (np. fibroblastów), niestety w przypadku innych rodzajów komórek, takich jak często badane przez nas komórki krwi, jej przydatność natrafia na ograniczenia. Inne metody, takie jak oznaczanie zawartości białka w niektórych markerach autofagosomalnych lub stosowanie konstruktów reporterowych, również okazały się w naszych badaniach próbek krwi problematyczne. Do badań na komórkach krwi (limfocytach) wykorzystujemy metodę oznaczania poziomu LC3BII. W tym celu izolujemy limfocyty z próbek pełnej krwi tak szybko, jak tylko to możliwe, po czym oznaczamy ilość LC3BII, czyli markera autofagosomów, wykorzystując do tego celu zabarwione przeciwciała. Poziom LC3BII dostarcza nam informacji o intensywności autofagii.
W międzyczasie udało nam się ten test zoptymalizować, dzięki czemu możemy go wykorzystać do prowadzenia wiarygodnych badań in vivo/ex vivo, jak np. do badania wpływu odżywiania (post terapeutyczny / program żywieniowy EPD®).
Czy autofagia odgrywa kluczową rolę w chorobach i procesach starzenia?
Autofagia odgrywa kluczową rolę w zapobieganiu wielu poważnym chorobom. Proces ten pełni z reguły ważną funkcję ochronną. Jednak w pewnych nielicznych przypadkach funkcja autofagii polegająca na wspomaganiu przeżywalności komórek może okazać się szkodliwa. W kontekście chorób neurodegeneracyjnych panuje przekonanie, że sprawnie działająca autofagia pełni ważną funkcję ochronną. Funkcja ta polegałaby na eliminowaniu zmutowanych białek, które są podatne na agregację, dlatego słabo poddają się rozkładowi w proteasomach. U podłoża chorób wątroby również leżą białka ze skłonnością do agregacji. Aktywacja autofagii mogłaby okazać się tu równie pomocna, co w przypadku chorób neurodegeneracyjnych. Powstaje też pytanie, czy autofagia mogłaby także pełnić rolę w ogólnej ochronie wątroby przed alkoholem i innymi substancjami hepatotoksycznymi. Również w kontekście chorób zwyrodnieniowych mięśni, wśród możliwych przyczyn wymienia się dysfunkcje autofagii. Czynnikami ograniczającymi zdolności miocytów do porządków w cytoplazmie mogą być agregacje białek oraz zaburzenia fuzji autofagosomów z lizosomami. Hipotezę tę zdają się potwierdzać eksperymenty polegające na hamowaniu takich fuzji przez chlorochinę, co również prowadzi do poważnych miopatii. Kardiomiocyt jest komórką postmitotyczną, w której autofagia może pełnić ważną kontrolę nad jakością białek i organelli. Ze względu na wysokie zapotrzebowanie na ATP komórkach sercowych, zaburzenia autofagii często przejawiają się trwałym upośledzeniem funkcji serca.
Układ autofagiczny odgrywa też ważną rolę w infekcjach. Jedynie autofagia jest w stanie rozkładać na podstawowe elementy całe organelle komórkowe, a także patogeny, które zaatakowały komórkę, takie jak wirusy. Proces eliminacji patogenów może przebiegać na zasadzie autofagii selektywnej lub nieselektywnej. Wywołanie autofagii przez infekcję wirusową (wirofagia) może wspierać komórkową odpowiedź organizmu na wiele sposobów, np. poprzez aktywację wrodzonego układu odpornościowego, wspieranie produkcji interferonu, selektywne kierowanie cząstek wirusa do lizosomu oraz wzmacnianie odporności adaptacyjnej poprzez prezentację antygenu. Dlatego autofagia jest również ważnym uzupełnieniem systemu ubikwityna-proteasom. Mimo tak niebywale skutecznego mechanizmu obronnego, wirusom udaje się go nie tylko hamować (np. poprzez blokowanie białek ATG), ale nawet wykorzystywać do własnych potrzeb (np. wirus może w pewnych warunkach wykorzystywać autofagosom do replikacji wirusowego RNA).
Autofagocytoza ma niewątpliwie kluczowe znaczenie dla utrzymania w naszych komórkach skomplikowanej równowagi między syntezą a rozkładem białek i organelli, zatem odgrywa fundamentalną rolę w utrzymaniu naszego zdrowia. Niemniej z punktu widzenia stymulacji tego procesu, rola autofagii w nowotworach była dotychczas postrzegana bardzo krytycznie. W szybko rosnących guzach zwykle brakuje składników odżywczych z powodu powolnego wrastania w guz nowych naczyń krwionośnych zaopatrujących jego tkankę.
A to oznacza, że progresji różnych rodzajów nowotworu może towarzyszyć wzmożona autofagia. Dlatego mówi się niekiedy o „yin i yang autofagii” lub o efekcie obosiecznego miecza. Niemniej pogląd, jakoby autofagia przysługiwała się naszemu zdrowiu w komórkach zdrowych, za to działała na naszą szkodę w komórkach nowotworowych, przejawiając cechy obosiecznego miecza (zdrowy/nowotworowy), jest raczej nadużyciem.
Wykazano, że ograniczona autofagia mogłaby sprzyjać rozwojowi raka. Na przykład, stres może prowadzić do kryzysów replikacyjnych, w których komórki – wbrew regułom – kontynuują podziały mimo mocno skróconych telomerów. Stymulując autofagię, można by wywoływać śmierć komórkową tych potencjalnie niebezpiecznych komórek, zapobiegając w ten sposób rozwojowi raka.
Słabnięcie autofagii jest jedną z charakterystycznych cech procesu starzenia. Warto jednak traktować autofagię nie tylko jako samodzielną cechę, lecz także postrzegać ją w interakcji z innymi oznakami starzenia się, w której to interakcji pełni ważną rolę. Postępujące z wiekiem zaburzenia funkcji autofagii prowadzą do utraty proteostazy. Cechą komórek wszystkich organizmów jest to, że wraz z wiekiem gromadzi się w nich coraz więcej uszkodzonych makrocząsteczek i wadliwych organelli. Zjawisko to może nasilać choroby związane z wiekiem. Badania przeprowadzone na różnych organizmach wykazały, że stymulacja autofagii może mieć pozytywny wpływ na oczekiwaną długość życia. Uzyskane dotąd wyniki odnoszą się niemal wyłącznie do organizmów modelowych. Jednak badania nad rolą autofagii w procesach starzenia u ludzi wniosą w przyszłości niezwykle ważny wkład w temat „zdrowego starzenia się”.
Spowolnienie autofagii jest charakterystycznym wyznacznikiem procesu starzenia się. Związane jest z zaburzeniami metabolicznymi i licznymi chorobami, takimi jak procesy neurodegeneracyjne, infekcje i stany zapalne. W przypadku chorób nowotworowych działanie autofagii bywa przyrównywane do działania obosieczego miecza. Koncepcje terapeutyczne bazujące na modulowaniu autofagii wydają się niezwykle obiecujące w wielu dziedzinach medycyny. Działania na rzecz zrównoważonej autofagii stanowią już dziś obiecujące podejście do zdrowego stylu życia i zdrowego starzenia się.
W przypadku modulowania autofagii obowiązuje zasada „zmierz – zadziałaj – zmierz”, nie sprawdza się natomiast zasada „im więcej, tym lepiej”. Chodzi o to, by rozpoznawać stany zaburzonej równowagi i kompensować je w ukierunkowany sposób, czyli stosownie do potrzeb. W przeciwnym razie grozi nam spotęgowana reakcja organizmu, która przyniesie niekorzystne skutki. I tak na np. nadmiernie wysoki / niekontrolowany poziom autofagii może wywołać „śmierć komórki zależną od autofagii” zwaną autozą. Autoza jest formą śmierci komórki, która nie jest związana ani z programowaną śmiercią komórki czyli apoptozą, ani z obumieraniem tkanek czyli nekrozą, lecz wynika wyłącznie z autofagii. Można ją rozpoznać m.in. po pęcznieniu przestrzeni okołojądrowej. Cecha ta bywa określana mianem „ciemnej strony autofagii”. Zasadniczo jednak stymulowanie autofagii jest procesem pożądanym, szczególnie w sytuacjach naturalnego spowolnienia autofagii (wskutek starzenia się) lub zapotrzebowania organizmu na wzmożoną autofagię (np. przy infekcjach).12-19
Jak sprawić, by modulowanie autofagii było zdrowe?
Skoro autofagia ma tak doniosłe znaczenie dla zachowania zdrowia, to pożądane są wszelkie strategie, które pozwalają nam ją stymulować.
Czynnikiem najskuteczniej aktywującym autofagię jest ograniczenie spożycia pokarmów, jak to się dzieje w trakcie postu. Jest zatem oczywiste, że dieta ma znaczący wpływ na modulację autofagii. Restrykcja kaloryczna (CR) prowadzi do aktywacji komórkowego czujnika energii (AMPK), ponieważ komórka wpada w stan wyczerpania energetycznego. W celu oszczędzania energii procesy komórkowe przyśpieszają, co sprzyja rozkładaniu starych składników komórek na podstawowe elementy budulcowe, które komórka może ponownie wykorzystać do syntezy nowych składników. Co na pierwszy rzut oka może wydawać się dziwne, jest de facto dowodem na to, jak wydajnie działa nasz organizm.
Warto podkreślić, że restrykcja kaloryczna nie ma nic wspólnego z niedożywieniem. Polega wyłącznie na ograniczeniu spożycia kalorii w porównaniu ze standardowym stylem przyjmowania pokarmów (ad libitum czyli do woli). Wszystkie ważne procesy życiowe otrzymują nadal niezbędne zasilanie. Koncepcję tę wdraża się również w wielu formułach terapii żywieniowej, takich jak dieta Mayra lub program żywieniowy EPD®. Przeprowadziliśmy kilka (dotąd nieopublikowanych) badań poświęconych temu zagadnieniu, które pokazują, że
- w trakcie postu przerywanego (25 godzin) zaobserwowano stymulację autofagii, chociaż sam proces był mocno zindywidualizowany czyli miał różny przebieg u poszczególnych osób,
- w przypadku diety Mayra i programu żywieniowego EPD® obserwowano tym wyższą stymulację, im niższe były wartości wyjściowe (przywracanie równowagi),
- u starszych uczestników obserwowano niskie podstawowe poziomy autofagii, które jednak równie dobrze poddawały się stymulacji.
Kontynuujemy prace nad tym zagadnieniem w formie kolejnych badań, ale już teraz widać, że pomiary intensywności autofagii mogłyby przyczynić się do podkreślenia wagi tych terapii. Ponadto, pomiary autofagii mogłyby stanowić kolejne ważne badanie towarzyszące głównej terapii, zgodnie z zasadą „zmierz – zadziałaj – zmierz”.
Oprócz ilości kalorii, znaczący wpływ na odżywianie ma również rodzaj diety. Nie jest tajemnicą, że w krajach południowych, gdzie dominuje dieta śródziemnomorska, oraz w niektórych częściach Azji, w tak zwanych niebieskich strefach, rośnie liczba stulatków, w czym także ma swój udział autofagia. Za stymulację autofagii odpowiadają tam określone substancje występujące naturalnie w żywności, które są powszechniejsze w tamtejszej diecie niż w innych częściach świata.
Mimetyki restrykcji kalorycznej (CRM) to substancje, które mogą naśladować i uzupełniać – ale nie zastępować – pozytywne skutki ograniczenia kalorii. Należą do nich naturalne substancje, takie jak spermidyna, resweratrol i rapamycyna. Wykazano, że zwłaszcza spermidyna, będąca strukturalnie poliaminą, wywiera na autofagię silnie stymulujący wpływ. Dlatego uważa się ją za naturalną poliaminę stymulującą autofagię, a nawet za „fontannę młodości dla komórek”. Oprócz syntezy endogennej, organizm wchłania też spermidynę z pożywienia. Pokarmy bardzo bogate w spermidynę obejmują kiełki pszenicy, soję, ser, grzyby, groch, orzechy, jabłka, gruszki i brokuły. Spermidynę wytwarzają też mikroorganizmy zasiedlające przewód pokarmowy. Oprócz uzyskiwania tych substancji z żywności, możemy je również przyjmować w postaci suplementów diety.
Oprócz odżywiania (jak również interwencji farmakologicznych lub przyjmowania suplementów diety) istotną rolę w modulowaniu autofagii odgrywają ćwiczenia fizyczne. Również w tym przypadku następuje indukcja autofagii, za którą odpowiada stres energetyczny. Aktywność fizyczna powoduje zużywanie zasobów ATP, których niedobór aktywuje kinazę AMPK, a ta z kolei mobilizuje autofagię. Omawiając procesy redukujące wspomniany stres, nie należy pominąć ważnej roli spacerów („kąpiele leśne”).20-24
Podsumowanie
Zdrowe starzenie się zależy w pierwszym rzędzie od funkcjonowania naszych komórek. Cechami wspólnymi dla procesów starzenia komórkowego są: słabnięcie endogennych mechanizmów ochronnych i zwiększona podatność komórek na uszkodzenia powodowane czynnikami egzogennymi, takimi jak toksyny środowiskowe, złe odżywianie i promieniowanie. Dlatego tak ważne jest unikanie czynników działających na szkodę komórek, ale także podtrzymywanie własnych procesów naprawy i recyklingu komórek.
Komórki naszego ciała – jak również zawarte w nich organelle – wymieniają nieustannie informacje za pośrednictwem złożonych szlaków sygnalizacyjnych, współpracują ze sobą, dzielą się, starzeją i umierają. Kluczowe funkcje komórek powinny pozostawać w równowadze, zaś środki terapeutyczne powinny być ukierunkowane na wzmacnianie lub przywracanie tej równowagi. Przykładem mogą być procesy naprawy i recyklingu komórek, które są niezwykle złożone, muszą reagować na różne warunki środowiskowe i odgrywają ważną rolę w procesach starzenia. W badaniach nad skutecznością stosowanych środków należałoby w większym stopniu koncentrować się na komórkach, które znajdują się w stanie nierównowagi. Często nie obserwuje się poprawy w komórkach, które są w równowadze, co może prowadzić do błędnych interpretacji przy ocenie skuteczności nowych podejść terapeutycznych.
Zapewnienie równowagi między syntezą organelli i białek, a ich rozkładem, ma fundamentalne znaczenie dla regulowanego przebiegu procesów komórkowych. Autofagocytoza zapewnia demontaż uszkodzonych organelli i zagregowanych białek, realizując tym samym centralny wewnątrzkomórkowy program sprzątania komórek i recyklingu materiału budulcowego. Dzięki funkcji recyklingu autofagia przyczynia się do utrzymania funkcjonalności i witalności komórek. Stanowi zatem niezbędny program utrzymania zdrowia. Autofagia jest procesem podlegającym precyzyjnej regulacji. Rozległą wiedzę o tej regulacji zawdzięczamy głownie pracom Yoshinori Ohsumi. Mimo, że autofagocytoza przebiega nieustannie w każdej komórce naszego ciała na poziomie podstawowym, poziom jej nasilenia może ulegać modyfikacji pod wpływem bodźców zewnętrznych i wewnętrznych. Do najważniejszych czynników regulujących autofagię należą dieta, specjalne programy obejmujące naprzemiennie post i odżywianie, a także tzw. mimetyki ograniczenia kalorii. Mogą one odgrywać kluczową rolę w przywracaniu równowagi procesów autofagii, które uległy rozregulowaniu.
Autorzy: Prof. Dr. Jörg Bergemann, Melanie Scherer
O autorach:
Prof. dr Jörg Bergemann jest profesorem biologii molekularnej komórek w Wyższej Szkole Nauk Stosowanych w Albstadt-Sigmaringen. Pełniąc funkcję dziekana, sprawuje od 20 lat pieczę nad programem studiów magisterskich w dziedzinie nauk biomedycznych. Był wielokrotnie inicjatorem i realizatorem szeroko zakrojonych projektów badawczych w dziedzinie biologii komórki, współfinansowanych przez przemysł i strony trzecie. Prace te zaowocowały licznymi publikacjami, niektóre z nich zostały wyróżnione nagrodami. W swoich badaniach skupia się na analizowaniu procesów komórkowych (naprawa, stymulacja, regeneracja, ochrona), w szczególności zaś na wpływie odżywiania, starzenia, substancji czynnych i metod biofizycznych na funkcje molekularne komórek. Prof. Bergemann kieruje też (na część etatu) Centrum Badawczym Steinbeis IVA, działając w sekcji szkoleń i podnoszenia kwalifikacji zawodowych (seria wykładów poświęconych mechanizmom starzenia biologicznego i możliwościom wpływania na ich przebieg) oraz doradztwa (systemy testów biologicznych z wykorzystaniem komórek).
Melanie Scherer jest doktorantką i stypendystką Kooperacyjnego Kolegium Doktoranckiego (KPK) InViTe2 działającego przy Uniwersytecie Doskonałości w Konstancji / Uniwersytecie Nauk Stosowanych w Albstadt-Sigmaringen. Jest członkinią zespołu roboczego prof. dr Jörga Bergemanna. W ramach swojej pracy doktorskiej bada molekularny wpływ ograniczenia kalorii na stymulację procesów regeneracji komórkowej, w tym zwłaszcza na autofagię.
Artykuł został opublikowany w OrthoNewsletter 5 / 4.2024
Bibliografia
- Buscher, Hans-Peter: Autophagie. Online verfügbar unter https://www.medicoconsult.de/autophagie.
- Dikic, Ivan; Elazar, Zvulun (2018): Mechanism and medical implications of mammalian autophagy. In: Nature reviews. Molecular cell biology 19 (6), S. 349–364. DOI: 10.1038/s41580-018-0003-4.
- Domanski, Paul: Recycling der Zelle: Autophagozytose und die Ubiquitin-Proteasom-Prozesse. Online verfügbar unter https://www.biomol.com/de/ressourcen/biomol-blog/recycling-der-zelle-autophagozytose-und-die-ubiquitin-proteasom-prozesse.
- Escobar, Kurt A.; Cole, Nathan H.; Mermier, Christine M.; VanDusseldorp, Trisha A. (2019): Autophagy and aging: Maintaining the proteome through exercise and caloric restriction. In: Aging cell 18 (1), e12876. DOI: 10.1111/ acel.12876.
- Hansen, Malene; Rubinsztein, David C.; Walker, David W. (2018): Autophagy as a promoter of longevity: insights from model organisms. In: Nature reviews. Molecular cell biology 19 (9), S. 579–593. DOI: 10.1038/s41580-018-0033-y.
- He, Li-qiang; Lu, Jia-hong; Yue, Zhen-yu (2013): Autophagy in ageing and ageing-associated diseases. In: Acta pharmacologica Sinica 34 (5), S. 605–611. DOI: 10.1038/aps.2012.188.
- Kim, Junhyeong; Chee, Woei-Yaw; Yabuta, Norikazu; Kajiwara, Kentaro; Nada, Shigeyuki; Okada, Masato (2020): Atg5-mediated autophagy controls apoptosis/anoikis via p53/Rb pathway in naked mole-rat fi broblasts. In: Biochemical and biophysical research communications 528 (1), S. 146–153. DOI: 10.1016/j.bbrc.2020.05.083.
- Lamark, Trond; Johansen, Terje (2012): Aggrephagy: selective disposal of protein aggregates by macroautophagy. In: International journal of cell biology 2012, S. 736905. DOI: 10.1155/2012/736905.
- Lee, Shin-Hae; Min, Kyung-Jin (2013): Caloric restriction and its mimetics. In: BMB reports 46 (4), S. 181–187. DOI: 10.5483/BMBRep.2013.46.4.033.
- Levine, Beth; Kroemer, Guido (2008): Autophagy in the pathogenesis of disease. In: Cell 132 (1), S. 27–42. DOI: 10.1016/j.cell.2007.12.018.
- Liang, Shan; Wu, Yun-Shan; Li, Dong-Yi; Tang, Ji-Xin; Liu, Hua-Feng (2021): Autophagy in Viral Infection and Pathogenesis. In: Frontiers in cell and developmental biology 9, S. 766142. DOI: 10.3389/fcell.2021.766142.
- Liu, Y.; Levine, B. (2015): Autosis and autophagic cell death: the dark side of autophagy. In: Cell death and differentiation 22 (3), S. 367–376. DOI: 10.1038/ cdd.2014.143.
- Locatelli, Andrea G.; Cenci, Simone (2022): Autophagy and longevity: Evolutionary hints from hyper-longevous mammals. In: Frontiers in endocrinology 13, S. 1085522. DOI: 10.3389/fendo.2022.1085522.
- López-Otín, Carlos; Blasco, Maria A.; Partridge, Linda; Serrano, Manuel; Kroemer, Guido (2023): Hallmarks of aging: An expanding universe. In: Cell 186 (2), S. 243–278. DOI: 10.1016/j.cell.2022.11.001.
- Madeo, Frank; Eisenberg, Tobias; Pietrocola, Federico; Kroemer, Guido (2018): Spermidine in health and disease. In: Science (New York, N.Y.) 359 (6374). DOI: 10.1126/science.aan2788.
- Madeo, Frank; Pietrocola, Federico; Eisenberg, Tobias; Kroemer, Guido (2014): Caloric restriction mimetics: towards a molecular defi nition. In: Nature reviews. Drug discovery 13 (10), S. 727–740. DOI: 10.1038/nrd4391.
- Mizushima, Noboru; Ohsumi, Yoshinori; Yoshimori, Tamotsu (2002): Autophagosome formation in mammalian cells. In: Cell structure and function 27 (6), S. 421–429. DOI: 10.1247/csf.27.421.
- Mowers, E. E.; Sharifi , M. N.; Macleod, K. F. (2017): Autophagy in cancer metastasis. In: Oncogene 36 (12), S. 1619–1630. DOI: 10.1038/onc.2016.333.
- Nassour, Joe; Radford, Robert; Correia, Adriana; Fusté, Javier Miralles; Schoell, Brigitte; Jauch, Anna et al. (2019): Autophagic cell death restricts chromosomal instability during replicative crisis. In: Nature 565 (7741), S. 659–663. DOI: 10.1038/s41586-019-0885-0.
- Rodriguez, Karl A.; Wywial, Ewa; Perez, Viviana I.; Lambert, Adriant J.; Edrey, Yael H.; Lewis, Kaitlyn N. et al. (2011): Walking the oxidative stress tightrope: a perspective from the naked mole-rat, the longest-living rodent. In: Current pharmaceutical design 17 (22), S. 2290–2307. DOI: 10.2174/138161211797052457.
- Tsukada, M.; Ohsumi, Y. (1993): Isolation and characterization of autophagydefective mutants of Saccharomyces cerevisiae. In: FEBS letters 333 (1-2), S. 169–174. DOI: 10.1016/0014-5793(93)80398-E.
- Varghese, Nimmy; Werner, Selina; Grimm, Amandine; Eckert, Anne (2020): Dietary Mitophagy Enhancer: A Strategy for Healthy Brain Aging? In: Antioxidants (Basel, Switzerland) 9 (10). DOI: 10.3390/antiox9100932.
- Yang, Ming; Luo, Shilu; Wang, Xi; Li, Chenrui; Yang, Jinfei; Zhu, Xuejing et al. (2021): ER-Phagy: A New Regulator of ER Homeostasis. In: Frontiers in cell and developmental biology 9, S. 684526. DOI: 10.3389/fcell.2021.684526.
- Zhao, Shanmin; Lin, Lifang; Kan, Guanghan; Xu, Chang; Tang, Qiu; Yu, Chenlin et al. (2014): High autophagy in the naked mole rat may play a signifi cant role in maintaining good health. In: Cellular physiology and biochemistry: international journal of experimental cellular physiology, biochemistry, and pharmacology 33 (2), S. 321–332. DOI: 10.1159/000356672




