Wyobraź sobie, że w Twoim organizmie znajduje się cudowny pstryczek elektryczny, który włącza lub wyłącza w nim różne lampki, czyli pobudza do działania bądź dezaktywuje liczne enzymy, substancje czynne, a nawet całe procesy. Pomyśl, że Twoje ciało jest jak dom, w którym awaria takiego pstryczka oznacza, że np. światło w salonie będzie świeciło się przez całą noc, albo że nie będziesz mógł włączyć lampki w sypialni, aby poczytać ulubioną książkę. Takim niezmiernie istotnym włącznikiem i wyłącznikiem jest zachodzący w każdej sekundzie naszego życia proces, który nazywa się – metylacja.
Czym jest ten wciąż mało znany ludziom proces i dlaczego odgrywa tak ważną rolę dla naszego zdrowia oraz dobrego samopoczucia?
Metylacja
Metylacja to nic innego jak przekazywanie grupy metylowej (-CH3) pomiędzy molekułami. Polega na podstawieniu u tzw. biorcy atomu wodoru przez trzy atomy wodoru oraz jeden atom węgla, którą oddaje cząsteczka nazywana donorem. Enzym lub substancja chemiczna, do której przyłącza się grupa metylowa ulega aktywacji i może pełnić w ten sposób przynależną mu funkcję. Bez metylacji ten sam enzym/substancja jest biochemicznie NIEAKTYWNA.
Proces metylacji odpowiada w naszym organizmie za:
- zapewnianie biodostępności witaminy B12 (przekształca ją z cyjanokobalaminy do aktywnej metylokobalaminy),
- zapewnianie biodostępności kwasu foliowego (kwas foliowy przekształca się w aktywne 5-MTHF, czyli kwas lewomefoliowy),
- współreguluje ekspresję genów,
- współreguluje syntezę DNA i RNA,
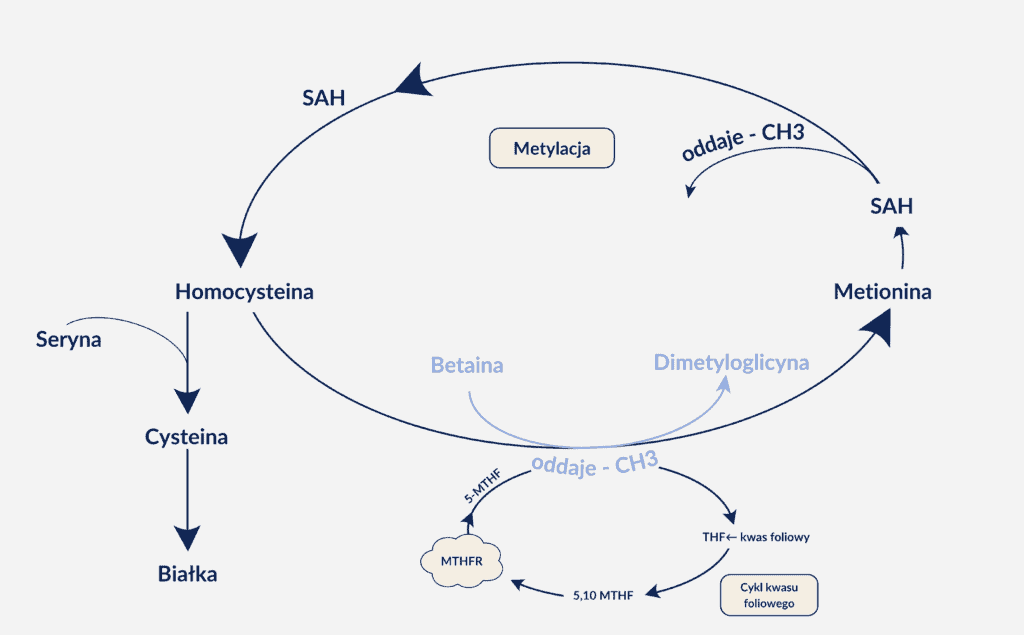
- eliminację nadmiaru homocysteiny oraz utrzymanie jej prawidłowego poziomu (homocysteina to niebiałkowy aminokwas siarkowy, który w nadmiarze prowadzi do uszkodzeń naczyń krwionośnych oraz zaburzeń funkcjonowania układu nerwowego, np. depresji czy chorób neurodegeneracyjnych. W normalnych warunkach dzięki tzw. remetylacji (czyli ponownego przyłączenia grup metylowych) homocysteina ulega przemianie w L-metioninę. Czym są te normalne warunki?
Remetylacja
Do remetylacji (czyli ponownego przyłączenia grup metylowych) homocysteiny niezbędne są dwa czynniki:
- aktywny enzym MTHFR czyli reduktaza metylenotetrahydrofolianu, który przekształca 5,10-metylenotetrahydrofolian do 5-metylotetrahydrofolianu czyli wspomnianego już kwasu lewomefoliowego (5-MTHF). Enzym MTHF zawiera kofaktor flawinowy i wykorzystuje jako reduktor NAD(P)H.
- betaina (jako donor – dawca grupy metylowej) i kwas foliowy, który musi zostać następnie przekształcony w aktywne 5-MTHF. Betainę możemy sami otrzymywać z choliny, jednak warunkiem udanej biosyntezy betainy jest sprawny enzym mitochondrialny, oksydaza cholinowa oraz prawidłowo funkcjonująca wątroba i/lub nerki.
Graficznie wygląda to tak:
Rys. Cykl kwasu foliowego a remetylacja homocysteiny
Zaburzenia metylacji
Problem w tym, iż szacunkowo około 40-50% populacji cierpi z powodu zaburzeń metylacji, spowodowanych mutacją genu kodującego enzym MTHFR. Oznacza to, że osoby dotknięte wspomnianą mutacją nie są w stanie przekształcić kwasu foliowego w jego aktywną postać. To właśnie z dymorfizmem genu MTHFR wiąże się słynny problem z suplementacją kwasu foliowego oraz dodawaniem go do żywności w USA. Przeprowadzone analizy dowiodły, iż zwiększenie podaży kwasu foliowego w diecie u kobiet wpływało tylko w niewielkim stopniu na spadek uszkodzeń płodów, a co więcej – zwiększyło ilość urodzeń dzieci z zespołem Downa. Podejrzenie zaburzenia metylacji pojawia się w momencie stwierdzenia wysokiego poziomu kwasu foliowego we krwi. Kwas foliowy krąży w organizmie, lecz nie ulega bioaktywacji. Niepokojący jest także wysoki poziom homocysteiny, która nie ulega wystarczającemu rozłożeniu.
Mutacje genu MTHFR
Na gen kodujący MTHFR składa się aż 20 373 par zasad. Wystarczy, że jedna z nich zostanie zmutowana, aby rozsypać całą misterną układankę. Najczęstsze mutacje występują w pozycji 677 i 1298, stąd nazwa najczęściej oznaczanych modyfikacji genu: MTHFR C677T oraz MTHFR A1298C.
Pełna diagnostyka mutacji genu MTHFR jest jak dotąd w Polsce niedostępna. Rodzime laboratoria oferują jedynie badanie dymorfizmu genu: MTHFR C677T oraz MTHFR A1298C, zaś bardziej szczegółowe badania możesz zlecić poprzez specjalistyczne strony internetowe (badania wykonują laboratoria w Stanach Zjednoczonych).
Metylacja jest niezbędna do utrzymania odpowiedniego poziomu selenu w organizmie, ponieważ zarówno nadmiar, jak i niedobór tego pierwiastka jest dla nas toksyczny. Nadmiar związków selenu może być usuwany z organizmu właśnie dzięki metylacji. Pierwszy etap przemian nieorganicznych form tego pierwiastka to redukcja nieorganicznego selenu (z +6 do +4) przy pomocy zredukowanego glutationu (którego obecność zależy pośrednio również od metylacji) oraz NADPH. Ostatecznie selen nieorganiczny ulega przemianie do selenowodoru, który albo ulega wydaleniu (dzięki metylacji!5), albo staje się substratem do syntezy selenobiałek. Selenobiałka otrzymujemy poprzez połączenie selenu z aminokwasami – najczęściej cysteiną lub metioniną, a ich ilość zależy przecież od metylacji. Niezmetylowane formy selenu ulegają wydaleniu z organizmu wraz z moczem lub drogami oddechowymi3.
Metylacja jest również kluczowa dla syntezy glutationu oraz peroksydazy glutationowej.
Glutation
Glutation, czyli jeden z naszych najpotężniejszych przeciwutleniaczy otrzymujemy z aminokwasów: glutamina i cysteina, przy aktywnym udziale enzymu syntetaza glutationowa4. Tymczasem podaż aminokwasu cysteina zależy od sprawnego metabolizmu homocysteiny (o którym decyduje pośrednio właśnie metylacja, patrz Rysunek nr 1).
Od sprawnej metylacji zależy również obecność enzymu peroksydaza glutationowa, czyli tzw. wymiatacza wolnych rodników. W skład tego enzymu wchodzi selenocysteina, a bez sprawnej metylacji metabolizm zarówno selenu, jak i cysteiny ulega zaburzeniu. Substratem do syntezy peroksydazy glutationowej jest glutation. Mówimy, że peroksydaza glutationowa to utleniony glutation.
Co zaburza metylację?
- Niektóre leki (np. statyny, inhibitory pompy protonowej).
- Niedostateczna podaż dawców grup metylowych (betainy oraz metioniny, a właściwie S-adenozylometioniny, która powstaje poprzez przekształcenie metioniny przy udziale ATP oraz jonów Mg+2, Mn+2 lub Co+2)
- Mutacja genu kodującego enzym MTHFR (omówiona wyżej).
Przykładowe skutki zaburzeń metylacji2
- Brak wykorzystywania witaminy B12 oraz kwasu foliowego, w skrajnych przypadkach możliwe zatrucie tymi witaminami.
- Niedobór glutationu i peroksydazy glutationowej (osłabienie bariery antyoksydacyjnej).
- Możliwy niedobór selenu (choroba Hashimoto, dysfunkcja układu immunologicznego, osłabienie bariery antyoksydacyjnej).
- Niewydolność bariery antyoksydacyjnej (stres oksydacyjny) oraz wynikające z tego przewlekłe stany zapalne, w tym zapalenia błony śluzowej jelit.
- Zbyt wysoki poziom homocysteiny (wzrost ryzyka chorób krążenia i chorób neurodegeneracyjnych, np. choroby Alzheimera).
- Nieszczelne jelita powodują przedostawanie się toksycznych metabolitów do ustroju, wywołując z kolei:
- zaburzenia neurologiczne, w tym depresję i schizofrenię czy autyzm,
- nietolerancje pokarmowe,
- inne zaburzenia autoimmunologiczne, np. astmę, choroby skóry, niewydolność układu hormonalnego (przeciwciała przeciwko plemnikom, komórkom jajowym, etc.),
- nowotwory – przewlekłe stany zapalne mają działanie kancerogenne,
- fibromialgię,
- zaburzenia pracy wątroby (glutation i peroksydaza glutationowa to kluczowe czynniki chroniące wątrobę) oraz związane z nimi zaburzenia gospodarki węglowodanowej i lipidowej, np. cukrzyca, insulinooporność, hipercholesterolemia, hiperlipidemia, hipoglikemia,
a nawet…
- przedwczesne siwienie (brak peroksydazy glutationowej, która wspomaga działanie antyoksydacyjnego enzymu katalaza, chroniącego nas przed siwymi włosami).
W przypadku występowania wyżej wymienionych dolegliwości, warto rozważyć odpowiednie badania genetyczne. Więcej informacji na ten temat znajdziesz w Internecie, przy czym w Polsce diagnostyka mutacji genu MTHFR dotyczy wyłącznie polimorfizmu genu C677T i A1298C.
Proponowana suplementacja przy zaburzeniach metylacji
W warunkach zakłóceń procesów metylacji szczególnego znaczenia nabiera odpowiednia postać przyjmowanych witamin: kwasu foliowego oraz witaminy B12. W sprzedaży najczęściej dostępna jest cyjanokobalamina: aktywna postać witaminy B12 (kobalaminy) z podstawnikiem cyjankowym (cyjanokobalamina jest najpowszechniej przepisywaną formą suplementacji wit. B12, ponieważ jest najbardziej stabilna). W organizmie cyjanokobalamina ulega przetworzeniu na metylokobalaminę, która następnie zmienia się w tzw. koenzym – B12 (określany też jako dibenkozyd lub adenozylokobalamina). Dibenkozyd to kofaktor dla mitochondrialnego enzymu mutaza metylomalonylo – CoA (MCM), niezbędnego np. do rozkładu cholesterolu, kwasów tłuszczowych oraz niektórych aminokwasów. Zauważ, że z tego względu bez sprawnej metylacji metabolizm wymienionych substancji ulega zaburzeniu.
Z drugiej strony suplementacja aktywnych biologicznie witamin zwiększa znacząco ich przyswajalność, a tym samym ryzyko przedawkowania. Na szczególną uwagę w tym względzie zasługuje kwas foliowy, który w nadmiarze wykazuje działanie cytotoksyczne i wiązany jest z procesami nowotworowymi. Dlatego duże znaczenie ma dobranie odpowiedniej dawki poszczególnych substancji czynnych. Dodatkowo, aby metylokobalamina oraz 5-MTHF mogły prawidłowo spełniać swoją funkcję niezbędne są również inne witaminy z grupy B, jako kofaktory poszczególnych enzymów (np. witamina B2 oraz B6). Odpowiedni skład oraz dawki mikroskładników odżywczych znajdziesz w na przykład preparacie B kompleks MSE®.
Pamiętaj!
Dobrym spożywczym źródłem kwasu lewomefoliowego są zielone warzywa6, w których ilość aktywnego 5-MTHF to nawet od 50 do 100% całkowitej podaży kwasu foliowego. Jest to jedna z przyczyn, dla których dieta mitochondrialna jest bogata w:
- kapustę,
- szpinak,
- brokuły,
- jarmuż,
- sałatę rzymską (tylko w sezonie!).
W warunkach dysfunkcji metylacji warto rozważyć też suplementację selenu organicznego i koenzymu Q10 (jako przeciwutleniacza oraz wsparcia dla mitochondrialnej produkcji ATP). Istotne jest też przyjmowanie preparatów zawierających betainę (donor grup metylowych) oraz preparatów mających na celu wzmocnienie ochrony antyoksydacyjnej (w tym środków chroniących wątrobę). Ze względu na rolę magnezu i manganu jako kofaktorów przemiany metioniny w S-AM, zalecana jest również suplementacja tych pierwiastków. Suplementacja powinna polegać na wdrożeniu tolerowanej, dostępnej biologicznie postaci, np. cytrynianu magnezu czy orotanu magnezu.
Jak widzisz, bez sprawnej metylacji cieszenie się pełnią zdrowia oraz dobrym samopoczuciem jest niemożliwe, a mechanizm przenoszenia grup metylowych to dla nas jeden z kilku kluczowych procesów metabolicznych. Jednym słowem: metylacja to rewelacja!
Autor: Sylwia Grodzicka
Bibliografia
- www.mayomedicallaboratories.com/test-catalog/Clinical+and+Interpretive/81648
- www.mthfr.net/
- www.ptfarm.pl/pub/File/Bromatologia/2016/Nr%204/Bromatologia%204_2016%20s%20818-829.pdf
- www.biotka.mol.uj.edu.pl/zbm/handouts/2010/AJ/stres_oksydacyjny/Wyklad-8.pdf
- www.panacea.pl/articles.php?id=211
- www.mindwhale.com/food-sources-of-l-methylfolate/